
【题目】常温下,甲、乙两烧杯盛有同浓度同体积的稀硫酸将纯锌片和纯铜片分别按图示方式插入其中,以下有关实验现象或结论的叙述正确的是
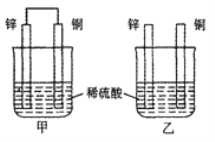
A. 两烧杯中铜片表面均有气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 甲杯溶液的c(H+)减小,乙杯溶液的c(H+)变大
D. 产生气泡的速率甲比乙快
【答案】D
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极, H+在铜极上得电子,生成氢气,总反应式为:Zn+H2SO4=ZnSO4+H2↑,乙装置中只是锌片与稀硫酸间发生了置换反应: Zn+H2SO4=ZnSO4+H2↑,没有电流产生,以此进行分析。
甲中形成铜锌原电池,锌作负极,失电子,铜作正极, H+在铜极上得电子,生成氢气,所以甲中铜片表面有气泡产生,A错误;乙中不构成原电池,铜片不是电极,B错误;甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,C错误;甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,D正确;正确选项D。


科目:高中化学 来源: 题型:
【题目】某学生为了探究影响化学反应速率的外界因素,进行以下实验。
(1)向100mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
①在0~1、1~2、2~3、3~4、4~5min各时间段中:
反应速率最大的时间段是________min,主要的原因可能是_____________________;
反应速率最小的时间段是________min,主要的原因可能是_____________________。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入________(填序号)。
a.蒸馏水 b.NaOH溶液 c.NaNO3溶液 d.Na2CO3溶液
(2)进行以下对比实验并记录实验现象。
实验 Ⅰ
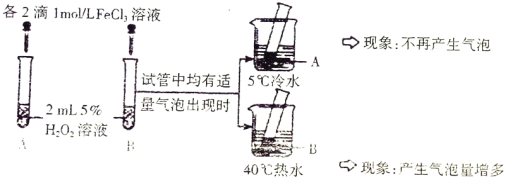
实验 Ⅱ:另取两支试管分别加入5mL5%eH2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡
产生。
①双氧水分解的化学方程式是________________。
②实验 Ⅰ 的目的是______________。
③实验 Ⅱ 未观察到预期现象,为了达到该实验的目的,可采取的改进措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾的再生利用是垃圾资源化的最佳途径.某垃圾箱上贴有如右图所示标志,应向此垃圾箱中丢弃的垃圾是( ) 
A.废旧电池
B.厨余垃圾
C.危险废物
D.可回收物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰( MnO2)和石英(SiO2).为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验.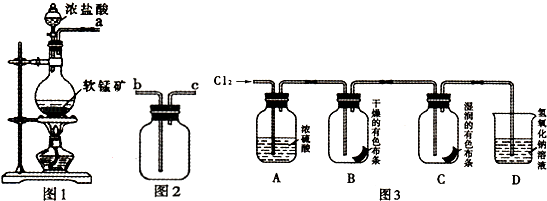
【查阅资料】MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)【制取气体】
取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是 .
(2)收集氯气应将图1导管的a接口与图2导管的接口连接(填“b”或“c).
(3)若生成标准状况下11.2L Cl2 , 则参加反应的MnO2的物质的量为 mol.
(4)【实验探究】
把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟.反应的化学方程是 .
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论 .
(6)写出C中反应的化学方程式: .
(7)【联系实际】
某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号).
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的分离方法不正确的是 ( )
A.用酒精萃取碘水中的碘B.用淘洗的方法从沙里淘金
C.用蒸馏的方法将自来水制成蒸馏水D.用过滤的方法除去食盐水中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:

(1)这些元素中,化学性质最不活泼原子的原子结构示意图为______;气态氢化物中,最稳定的是______;最高价氧化物对应水化物中,酸性最强的是_______。
(2)①和④两种元素的原子按1:1组成的常见化合物的电子式为______。
(3)②、③的单质中更容易与①的单质反应的是________(用化学式表示)。
(4)④、⑦、⑧、⑨的简单离子半径由大到小的顺序为_____(用离子符号和“>”表示)。
(5)⑥和⑧的最高价氧化物对应水化物之间发生反应的离子方程式____________。
(6)⑤⑨三种元素的单质沸点由高到低的顺序是_____(用化学式和“>”表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com