
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有关简单的烷烃的叙述:①都是易燃物;②特征反应是取代反应;③相邻两个烷烃在分子组成上相差一个甲基,其中正确的是( )
A.①和③ B.②和③
C.只有① D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是小王在医院做的血常规检查报告单的部分内容,小王应该注意补充的微量元素是( )
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×1012/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
A.硒 B.锌 C.铁 D.碘
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S△,Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。
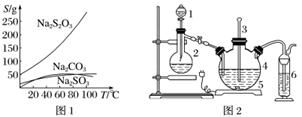
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按图2连接好装置。
(1)仪器2的名称为________________,装置6中可放入________________(填字母)。
A.BaCl2溶液
B.浓H2SO4
C.酸性KMnO4溶液
D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为
①Na2CO3+SO2===Na2SO3+CO2
②Na2S+SO2+H2O===Na2SO3+H2S
③2H2S+SO2===3S↓+2H2O
④Na2SO3+S△,Na2S2O3
总反应为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时至固体消失,即可停止通气和加热。若继续通入SO2,又会析出浅黄色沉淀,写出此时发生反应的离子方程式:________________________________________________。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
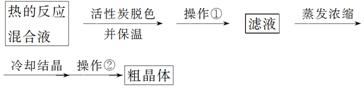
(1)为减少产品的损失,操作①为________,操作②是抽滤洗涤干燥,其中洗涤操作是用________________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高________________________________________________________________________。
(3)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。KMnO4溶液应置于________(填“酸式”或“碱式”)滴定管中。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成原理:CO(NH2)2+H2O2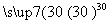 CO(NH2)2·H2O2。
CO(NH2)2·H2O2。
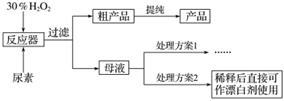
请回答下列问题:
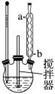
(1)流程图中反应器的装置如图所示,推测该反应的加热方式是______________________;回流管中冷水流从____________口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是__________________________。
(2)母液处理方案1可以是______________(用文字表达)。若欲从母液中分离出H2O2和尿素,可采用的操作是______(选填序号)。
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品2.000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L-1的硫酸,然后用0.100 0 mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00 mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式:______MnO +______H2O2+________________________
+______H2O2+________________________
H+===______Mn2++______H2O+______。
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量________。(填“偏高”、“偏低”或“不变”)
③根据滴定结果,可确定产品中活性氧的质量分数为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:
2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1) 在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)。
(2) 前2s内的平均反应速度v(N2)= 。
(3) 假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/ ℃ | NO初始浓度/ mol·L-1 | CO初始浓度/ mol·L-1 | 催化剂的比表面积/ m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①请在空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的II、III两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com