
【题目】下列关于元素周期表中的周期、族的理解正确的是( )
A.元素周期表中每个纵列代表一个主族或副族
B.元素周期表中只有三个短周期
C.每个周期均从金属元素开始,到非金属元素结束
D.同一主族元素的最外层电子数可能不等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(此时A下端活塞关闭)中。
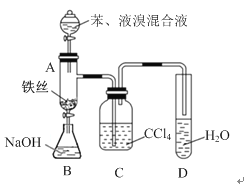
(1)写出A中反应的化学方程式__________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________,写出有关的离子方程式____________________;生成的有机物物位于溶液______层(填“上”或“下”)。
(3)C中盛放CCl4的作用是______________________;
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生________,则能证明;另一种验证的方法是向试管D滴加_____________,溶液变红色则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
Mn | Fe | ||
电离能 | I1 | 717 | 759 |
(kJ·mol-1) | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为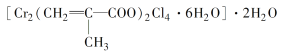
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用过滤的方法可分离碳酸钙和氯化钠溶液的混合物
B.为加快过滤,使用玻璃棒搅动漏斗里的液体
C.蒸发食盐水时,开始析出晶体后用玻璃棒搅拌
D.为加快蒸发的速度,可以加热至水全部蒸干得到晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式: _________
(2)灼烧海带用到的仪器有_____________
(3)提取碘的过程中,可供选择的有机试剂是(____)
A .酒精 B .四氯化碳
C .甘油 D .醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)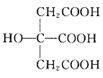 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
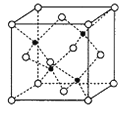
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅和二氧化硅的说法不正确的是( )
A.硅在地壳中的含量仅次于氧
B.硅在自然界中既有化合态,又有游离态
C.二氧化硅是石英、水晶的主要成分
D.硅单质的导电能力介于导体和绝缘体之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大___________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率______________。(设溶液体积不变)
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_________。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

①该反应的化学方程式是__________________________。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
A.X、Y、Z的反应速率相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com