
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
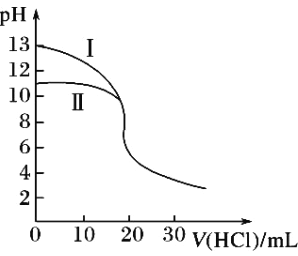
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
【答案】D
【解析】
A.根据氨水和氢氧化钾在滴定开始时的pH来判断;
B.盐酸与氨水恰好反应生成氯化铵,溶液显酸性;
C.滴定氢氧化钾溶液时,若V(HCl)>20mL,氢离子浓度可能大于钾离子浓度;
D.根据图像,V(HCl)=10mL时,溶液显碱性,即NH3H2O的电离程度大于NH4+的水解程度。
A.氢氧化钾为强碱,一水合氨是弱碱,在溶液中部分电离,相同浓度时,一水合氨的pH小于氢氧化钾,所以Ⅱ表示的是滴定氨水的曲线,故A正确;
B.滴定氨水消耗的V(HCl)=20mL,盐酸与氨水恰好反应生成氯化铵,溶液显酸性,c(Cl-)>c(NH4+),当pH=7时,滴定氨水消耗的V(HCl)<20mL,根据电荷守恒,c(Cl-)=c(NH4+),故B正确;
C.滴定氢氧化钾溶液时,若V(HCl)>20mL,H+浓度肯定大于OH-浓度,可能大于K+浓度,则溶液中离子浓度关系可能为:c(Cl-)>c(H+)>c(K+)>c(OH-),故C正确;
D.当滴定氨水消耗V(HCl)=10mL时,溶液中溶质为等物质的量的NH3H2O和NH4Cl,根据图像,V(HCl)=10mL时,溶液显碱性,即NH3H2O的电离程度大于NH4+的水解程度,因此离子浓度大小顺序为c(NH4+)>c(Cl-)>c(NH3H2O)>c(OH-)>c(H+),故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)

(1)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深,平衡向____________移动,NO2体积分数_______________
(2)压缩后U型管内左侧液面_______,右侧液面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.镀铜铁制品镀层破坏后,铁制品更易发生腐蚀
B.使用催化剂既能改变反应速率,又能改变焓变
C.其他条件不变时,升高温度,吸热反应的v正增大,v逆减小
D.工业电解精炼铜时,粗铜与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂 1 mol N—N键吸收193 kJ热量,断裂 1 mol N≡N键吸收941 kJ热量,则

A. N4与N2互称为同位素
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
A. SO2、O2分别为0.4 mol/L、0.2 mol/L B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L D. SO2为0.24 mol/L,SO3为0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为______________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验____________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g)ΔH=-
O2(g)===H2O(g)ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l)ΔH=-
O2(g)===H2O(l)ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:kJ)为
A. 0.4Q1+0.05Q3B. 0.4Q1+0.05Q2C. 0.4Q1+0.1Q3D. 0.4Q1+0.2Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com