
将5.6g铁粉投入盛有100mL 2mol•L﹣1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
A.v(Fe)=0.5 mol•L﹣1•min﹣1 B. v(H2SO4)=1 mol•L﹣1•min﹣1
C.v(H2)=1 mol•L﹣1•min﹣1 D. v(FeSO4)=0.5 mol•L﹣1•min﹣1
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列属于正 确的电离方程式是
确的电离方程式是
A.HCO3- + H2O  CO32- + H3O+ B.NH4+ + H2O
CO32- + H3O+ B.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
C.NaHCO3 Na+ + HCO3- D.H2S
Na+ + HCO3- D.H2S  2H+ + S2-
2H+ + S2-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2由此可知,该电池放电时的负极是( )。
Cd(OH)2+2Ni(OH)2由此可知,该电池放电时的负极是( )。
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiOOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+)
B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+)
C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
物质的量浓度相同(0.1mol/L)弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是 ( )
A.c(Na+)+c(H+)=c(X﹣)+c(OH﹣)
B.c(HX)+c(X﹣)=2c(Na+)
C.若溶液显酸性,则有:c(X﹣)>c(Na+)>c(HX)>c(H+)>c(OH﹣)
D.若溶液显碱性,则有:c(Na+)>c(HX)>c(X﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
某温度下,向pH=6的纯水中加入NaHSO4 晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性
D.NaHSO4晶体的加入抑制了水的电离
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.1 mol•L﹣1•min﹣1 B. v(N2)=0.2 mol•L﹣1•min﹣1
C.v(NH3)=0.15 D. v(H2)=0.3 mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:实验题
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
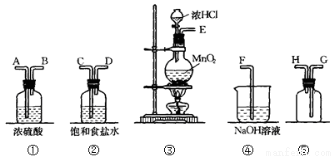
(1)连接上述仪器的正确顺序(填各接口处的字母):E接 ; 接 ; 接 ;
接 。
(2)装置中,饱和食盐水的作用是 ;NaOH溶液的作用是 。
(3)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到 ,
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl (浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目:
2KMnO4+16HCl (浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。
②该反应中被氧化和未被氧化的盐酸的物质的量之比是 ,如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将 。
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:填空题
乙苯催化脱氢制苯乙烯反应:
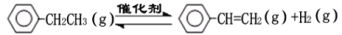
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=___________________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
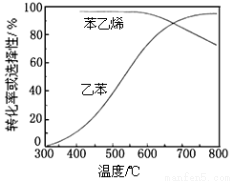
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 __________________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,
CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com