
| A. | 硝酸钠和金刚石 | B. | 冰和干冰 | C. | 晶体硅和水晶 | D. | 萘和苯 |
分析 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质,则氮化硼属于原子晶体,熔化时所克服的微粒间的作用力为共价键,然后判断选项中的晶体为原子晶体来解答.
解答 解:氮化硼超硬耐磨、耐高温,说明是原子晶体,
A.硝酸钠熔化克服离子键,金刚石熔化克服共价键,故A不选;
B.冰和干冰都是分子晶体,熔化克服的是分子间作用力,故B不选;
C.晶体硅和二氧化硅都是原子晶体,熔化克服共价键,故C选;
D.萘和苯均为分子晶体,克服的是分子间作用力,故D不选,故选C.
点评 本题考查晶体与化学键,明确不同类型晶体中的化学键是解答本题的关键,熟悉离子晶体中存在离子键,原子晶体中存在共价键即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用酸性KMnO4溶液除去乙烷中的乙烯 | |
| B. | 乙烷和乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉、油脂、蔗糖在一定条件下都能发生水解 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
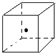 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
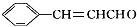 ,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3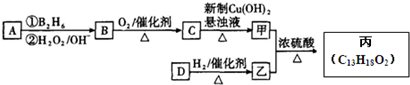
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
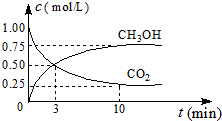 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com