
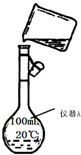
 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:分析 (1)根据仪器的外形来分析;
(2)容量瓶只有一条刻度线,应根据所配溶液的体积来选择合适的容量瓶;转移溶液时应该用玻璃棒引流;
(3)根据氯气与氢氧化钠的反应来计算.
解答 解:(1)根据仪器的外形可知,仪器A为容量瓶,故答案为:容量瓶;
(2)容量瓶只有一条刻度线,故配制500mL溶液应选择500mL容量瓶,向容量瓶转移溶液时应该用玻璃棒引流,否则易溅出液体而导致配制溶液浓度偏低,所以该图中错误为:容量瓶规格不对;未用玻璃棒引流;
(3)500mL0.2mol/L氢氧化钠溶液中氢氧化钠的物质的量为n=CV=0.2mol/L×0.5L=0.1mol,而漂白液中的有效成分为NaClO,设生成的NaClO的物质的量为xmol,根据反应可知:Cl2+2NaOH=NaCl+NaClO+H2O
2 1
0.1mol xmol
可知:$\frac{2}{0.1mol}=\frac{1}{xmol}$
解得x=0.05mol,
答:生成的漂白液的有效成分最多为0.05mol.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和仪器的选择分析,属于基础型题目,难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 16.8g | C. | 22.4g | D. | 33.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2和NO或NO2中的至少一种 | B. | 肯定只有NO | ||
| C. | 可能有Cl2和O2 | D. | 肯定没有Cl2、O2和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,减小压强,A的转化率增大 | |
| B. | 升高温度,减小体积,有利于平衡向正反应方向移动 | |
| C. | 增大A的浓度,平衡正向移动,A的转化率增大 | |
| D. | 降低温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com