
【题目】现有一种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数).质谱数据表明它的相对分子质量为84.已知该物质可能存在多种结构,A、B和C是其中的三种.请根据下列要求填空:
(1)该化合物的分子式为;
(2)A与氢气加成生成2﹣甲基戊烷,则A的结构可能有种(考虑顺反异构);
(3)经检验B不能使酸性高锰酸钾溶液褪色,且一氯代物只有两种,则B的结构简式为
(4)已知烯烃能发生反应: ![]()
C经臭氧化并经锌和水处理生成D和E,如图: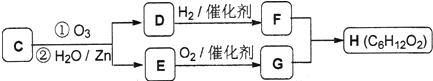
己知D常温为气体,H核磁共振氢谱显示有两组峰,峰面积之比为3:1.
①物质C的名称:;
②E与银氨溶液反应的化学方程式为:;
③F与G生成H的化学方程式为: .
【答案】
(1)C6H12
(2)5
(3)![]()
(4)3,3﹣二甲基﹣1﹣丁烯;(CH3)3CCHO+2Ag(NH3)2OH ![]() (CH3)3CCOONH4+2Ag↓+3NH3+H2O;(CH3)3CCOOH+CH3OH
(CH3)3CCOONH4+2Ag↓+3NH3+H2O;(CH3)3CCOOH+CH3OH ![]() (CH3)3CCOOCH3+H2O
(CH3)3CCOOCH3+H2O
【解析】解:(1)该有机物的相对分子质量为84,C的质量分数85.71%,H的质量分数14.29%,二者质量分数之和为100%,故该有机物属于烃,分子中C原子数目为 ![]() =6、H原子的数目为
=6、H原子的数目为 ![]() =12,故该有机物的分子式为C6H12 , 所以答案是:C6H12;
=12,故该有机物的分子式为C6H12 , 所以答案是:C6H12;
(2.)A与氢气加成生成2﹣甲基戊烷,则A分子中含有1个C=C双键,2﹣甲基戊烷的结构简式为(CH3)2CHCH2CH2CH3 , A的可能结构有:(CH3)2CHCH2CH=CH2、(CH3)2CHCH=CHCH3(存在顺反异构)、(CH3)2C=CHCH2CH3、CH2=CH(CH3)CH2CH2CH3所以答案是:5;
(3.)B不能使酸性高锰酸钾溶液褪色,说明B不含不饱和键,应为环烷烃,且其一氯代物只有两种,分子存在2种H原子,B含有1个三元环,环上每个碳原子连接一个甲基,故B的结构简式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)C发生臭氧氧化生成D与E,则C中含有碳碳双键,D常温为气体,则D为HCHO,D与氢气发生加成反应生成F为CH3OH,E氧化生成G为羧酸,G与F发生酯化反应生成H,H有两种不同化学环境的氢原子,醇F中甲基存在1种H原子,则剩余9个氢原子化学化学环境相同,故H中存在3个甲基,则G为(CH3)3CCOOH,E为(CH3)3CCHO,H为(CH3)3CCOOCH3 , C为(CH3)3CCH=CH2 ,
①C为(CH3)3CCH=CH2 , 化学名称为:3,3﹣二甲基﹣1﹣丁烯,所以答案是:3,3﹣二甲基﹣1﹣丁烯;
②E与银氨溶液反应的化学方程式为:(CH3)3CCHO+2Ag(NH3)2OH ![]() (CH3)3CCOONH4+2Ag↓+3NH3+H2O,
(CH3)3CCOONH4+2Ag↓+3NH3+H2O,
所以答案是:(CH3)3CCHO+2Ag(NH3)2OH ![]() (CH3)3CCOONH4+2Ag↓+3NH3+H2O;
(CH3)3CCOONH4+2Ag↓+3NH3+H2O;
③F与G生成H的化学方程式为:(CH3)3CCOOH+CH3OH ![]() (CH3)3CCOOCH3+H2O,所以答案是:(CH3)3CCOOH+CH3OH
(CH3)3CCOOCH3+H2O,所以答案是:(CH3)3CCOOH+CH3OH ![]() (CH3)3CCOOCH3+H2O.
(CH3)3CCOOCH3+H2O.


科目:高中化学 来源: 题型:
【题目】常温下,溶液中由水电离产生的c(OH﹣)=1×10﹣14molL﹣1,满足此条件的溶液中一定能大量共存的离子组是
A. Al3+ Na+ CO32﹣ Cl﹣ B. K+ Ba2+ Cl﹣ NO3﹣
C. K+ Na+ Cl﹣ CO32﹣ D. K+ NH4+ SO42﹣ NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NH4+、NH3、NH2﹣三种微粒的说法不正确的是( )
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:NH4+>NH3>NH2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I﹣等)中回收碘,其实验过程如图1: 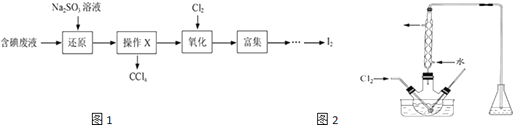
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I﹣ , 其离子方程式为该操作将I2还原为I﹣的目的是 .
(2)操作X的名称为 .
(3)氧化时,在三颈瓶中将含I﹣的水溶液用盐酸调至pH约为2,缓慢通入Cl2 , 在400C左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是;锥形瓶里盛放溶液作用的为 .
(4)已知:5SO32﹣+2IO3﹣+2H+═I2+5SO42﹣+H2O 某含碘废水(pH约为8)中一定存在I2 , 可能存在I﹣、IO3﹣中的一种或两种.请补充完整检验含碘废水中是否含有I﹣、IO3﹣的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I﹣的方法是;证明废水中含有IO3﹣的方法是 . (实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg![]() 。下列叙述中正确的是( )
。下列叙述中正确的是( )
①任何温度下,纯水的AG等于0
②溶液的AG越小,酸性越强
③25 ℃时,0.1 mol·L-1盐酸的AG=12
④25 ℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④
C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH=2的某酸稀释100倍,pH________4,pH=12的某碱稀释100倍,pH________10。
(2)室温时,将pH=5的H2SO4溶液稀释10倍,c(H+)∶c(SO42-)=________,将稀释后的溶液再稀释100倍,c(H+)∶c(SO42-)=________。
(3)
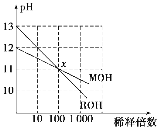
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如上图所示。下列叙述中不正确的是( )
A.MOH是一种弱碱
B.在x点,MOH完全电离
C.在x点,c(M+)=c(R+)
D.稀释前ROH溶液中c(OH-)是MOH溶液中c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把各组中的气体通入溶液中,溶液导电能力显著增强的是
A. CO2(g)通入NaOH溶液中
B. CO2(g)通入石灰水中
C. NH3(g)通入CH3COOH溶液中
D. NH3(g)通入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在酸性溶液中可以大量共存的是( )
A.K+、Na+、HCO3-、Cl-B.Na+、Al3+、SO42-、NO3-
C.NH4+、K+、OH-、SO42-D.Ba2+、Na+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是( )
A.氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++HCO ![]() +OH﹣═CaCO3↓+H2O
+OH﹣═CaCO3↓+H2O
B.氯气和水反应:Cl2+H2O═2H++Cl﹣+Cl﹣+ClO﹣
C.二氧化硅与烧碱溶液反应:SiO2+2OH﹣═SiO ![]() +H2O
+H2O
D.氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO ![]() +4NH
+4NH ![]() +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com