
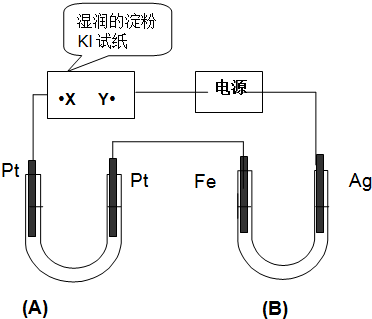
���� ����װ�ÿ�֪A��B��ʪ��ĵ���KI��ֽ�����ǵ��أ�ͨ���ʪ��ĵ���KI��ֽ��X�˱���ɫ˵���˵缫�Ϸ������ǵ�����ʧ����������I2���ж�XΪ������YΪ������B��Fe�缫Ϊ������AgΪ��������X������Pt�缫Ϊ��������Fe������Pt�缫Ϊ������
��1��AgΪ���������ʱAgʧ���ӷ���������Ӧ��
��2��Aװ������1L 2mol/L��Na2SO4��Һ�����Ե缫���ʵ�ʵ�����ˮ��������������������������������
��3��Bװ�õ�����AgΪ����ʧ���ӷ���������Ӧ���缫��ϸ��B��1L 2mol/L��AgNO3��Һ����Һ��Ag+����������ǿ���ȵõ����ӷ�����ԭ��Ӧ��Fe�缫����Ag��
��4����д�缫��Ӧʽ����ϵ����غ���������B��Fe�缫��������ΪAg���缫��ӦΪ��Ag++e-=Ag��A�������缫��ӦΪ4OH--4e-=2H2O+O2����
��� �⣺����װ�ÿ�֪A��B��ʪ��ĵ���KI��ֽ�����ǵ��أ�ͨ���ʪ��ĵ���KI��ֽ��X�˱���ɫ˵���˵缫�Ϸ������ǵ�����ʧ����������I2���ж�XΪ������YΪ������B��Fe�缫Ϊ������AgΪ��������X������Pt�缫Ϊ��������Fe������Pt�缫Ϊ������
��1������������֪AgΪ���������ʱAgʧ���ӷ���������Ӧ���缫��ӦΪ��Ag-e=Ag+��
�ʴ�Ϊ������Ag-e=Ag+��
��2��Aװ������1L 2mol/L��Na2SO4��Һ�����Ե缫���ʵ�ʵ�����ˮ����������������������������������Ӧ�Ļ�ѧ����ʽΪ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2 ����
�ʴ�Ϊ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2 ����
��3��Bװ�õ�����AgΪ����ʧ���ӷ���������Ӧ���缫��ϸ��B��1L 2mol/L��AgNO3��Һ����Һ��Ag+����������ǿ���ȵõ����ӷ�����ԭ��Ӧ��Fe�缫����Ag��Bװ���е�����Ϊ��Ag����ϸ��Fe����������ɫ����������
�ʴ�Ϊ��Ag����ϸ��Fe����������ɫ����������
��4�������£������һ��ʱ����õ�·��ͨ���ĵ��ӵ����ʵ���Ϊ0.2mol���������У�B��Fe�缫��������ΪAg���缫��ӦΪ��Ag++e-=Ag�������غ����õ�����Ag����=0.2mol��108g/mol=21.6g��A���ռ�������������������2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2 ����A�������缫��ӦΪ4OH--4e-=2H2O+O2��������ת��0.2mol����������O2���ʵ���=0.5mol����״�����������=0.5mol��22.4L/mol=1.12L��
�ʴ�Ϊ��21.6��1.12L��
���� �����ۺϿ�����ԭ���������ڿ���ѧ���ۺ����õ��֪ʶ����������Ŀ�Ѷ��еȣ�ע����յ����ɣ�����ȷ�жϵ缫����ʽ��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��Ǧ���ص���±ˮ����C1-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵������ȷ���ǣ�������
��Ǧ���ص���±ˮ����C1-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵������ȷ���ǣ�������| A�� | Ǧ���طŵ�ʱ���õ��������������С | |
| B�� | Ǧ���س��ʱ��B��Ӧ�����Դ�������� | |
| C�� | ����±ˮʱ��a�缫���ȷŵ����Cl-������Br-����ΪCl-�Ļ�ԭ��ǿ��Br- | |
| D�� | ��b������0.01 mol ����ʱ��Ǧ����������0.02 molH2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ʵ����� | ʵ������ | |
| �� | ͨ��һ��ʱ��N2������ | A�й����Ϊ����ɫ��B���а�ɫ������D�Թ�������ɫҺ�� |
| �� | �ô��л��ǵ�ľ������װ��D�ĵ��ܿ� | ľ����ȼ |
| �� | ��ַ�Ӧ��ֹͣ���ȣ���ȴ��ȡA�й��壬������ | �����ܽ⣬��Һ�ʻ�ɫ |
| �� | ����������Һ����D�Թ��� | ��Һ��Ϊdz��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�
�����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�
 ��X����±��ԭ�ӣ���
��X����±��ԭ�ӣ���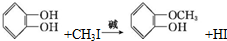 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | Fe3+ | AP+ | ZrO2+ |
| ��ʼ����pH | 1.9 | 3.3 | 6.2 |
| ���ڳ���pH | 3.2 | 5.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ���������к��ȵIJⶨʵ�飬������Ҫʹ���¶ȼƲ�4������ | |
| B�� | �������ظ������Һ��������NaOH���壬��Һ��ɫ�ɳ�ɫ������Ϊ��ɫ | |
| C�� | �ֱ�����֧ʢ��Ũ����ȵĴ���ͱ���������Һ�еμӵ�Ũ�ȵ�Na2CO3��Һ���۲쵽ǰ�߲������ݲ�����߾��� | |
| D�� | ��0.01mol/L��KMnO4��Һ�м���0.1mol/L��H2C2O4��Һ��ʵ�鿪ʼʱ��Һ��ɫ�ܿ죬������������Ҫ��������ҺŨ�ȱ仯���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com