
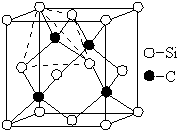
 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:分析 (1)氮气分子结构式为N≡N,三键中含有1个σ键、2个π键;Cu元素原子核外电子数为29,根据能量最低原理书写核外电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势;三种氢化物中甲烷为正四面体对称结构,分子中正负电荷重心重合,属于非极性分子;
(3)NF3分子中N原子孤电子对数=$\frac{5-1×3}{2}$=1、价层电子对数=3+1=4,杂化轨道数目为4;
(4)金刚砂硬度大,晶胞中Si、C原子之间形成共价键,为空间网状结构,属于原子晶体,晶胞中存在四面体构型,晶胞中Si、C原子位置可以互换,互换后以顶点C原子为研究对象,与之最近的C原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
晶胞中Si处于顶点与面心、C原子处于晶胞内部,利用均摊法计算晶胞中Si、C原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)氮气分子结构式为N≡N,三键中含有1个σ键、2个π键,分子中σ键和π键的比值为1:2,;Cu元素原子核外电子数为29,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1:2;1s22s22p63s23p63d104s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,故第一电离能为:F>N>C;三种氢化物中,氨气为三角锥形,属于极性分子,HF为双原子分子,共用电子对偏向F,为极性分子,甲烷为正四面体对称结构,分子中正负电荷重心重合,属于非极性分子,
故答案为:F>N>C;CH4;
(3)NF3分子中N原子孤电子对数=$\frac{5-1×3}{2}$=1、价层电子对数=3+1=4,为三角锥形结构,N原子杂化轨道数目为4,采取sp3杂化,
故答案为:三角锥形;sp3;
(4)金刚砂硬度大,晶胞中Si、C原子之间形成共价键,为空间网状结构,属于原子晶体,
晶胞中存在四面体构型,晶胞中Si、C原子位置可以互换,互换后以顶点C原子为研究对象,与之最近的C原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故每个C原子周围最近的C原子数目为$\frac{3×8}{2}$=12,
晶胞中Si处于顶点与面心,晶胞中Si元素数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,C原子处于晶胞内部,晶胞中C原子数目为4,故晶胞质量为4×$\frac{40}{{N}_{A}}$g,晶胞体积为(a cm)3,则晶胞密度为4×$\frac{40}{{N}_{A}}$g÷(a cm)3=$\frac{160}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:$\frac{160}{{N}_{A}{a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、分子结构与性质、杂化方式与空间构型判断、晶胞结构与计算等,(4)为易错点,需要学生具备一定的空间想象,难度中等.


科目:高中化学 来源: 题型:解答题
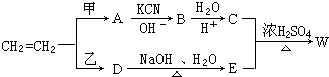
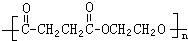 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
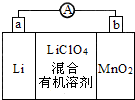
| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 | |
| B. | 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| C. | 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O | |
| D. | 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | H+、NH4+、HCO3-、NO3- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | Ag+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
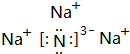 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醛的结构特点 | 可能的化学性质 |
| 有C=O双键,不饱和 | 与H2发生加成反应,乙醛表现氧化性 |
CHO中C-H键极性较强 | CHO中C-H键被氧化,变为C-OH |
| 实验 | 现象 | 结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 | 高锰酸钾溶液紫色变浅(褪去) | 乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 | 试管壁上出现银镜(一层光亮如镜的银) | 乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 | 出现红色沉淀 | 乙醛被氢氧化铜氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com