

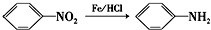 (苯胺,易被氧化)
(苯胺,易被氧化)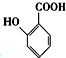 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2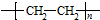
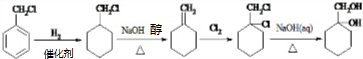 .
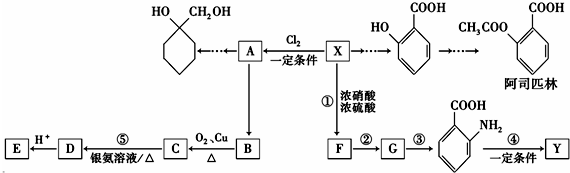
. 分析 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则 $\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为 ,C为
,C为 ,D酸化生成E,故D为
,D酸化生成E,故D为 ,E为
,E为 ;
; 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,
, 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为 ;
; 与乙酸发生酯化反应生成阿司匹林(
与乙酸发生酯化反应生成阿司匹林( ).
).
(6) 在催化剂条件下发生加成反应生成
在催化剂条件下发生加成反应生成 ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成 ,与氯气发生加成反应生成
,与氯气发生加成反应生成 ,最后在氢氧化钠水溶液中发生水解反应生成
,最后在氢氧化钠水溶液中发生水解反应生成 .
.
解答 解:相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则 $\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为 ,C为
,C为 ,D酸化生成E,故D为
,D酸化生成E,故D为 ,E为
,E为 ;
; 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,
, 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为 ;
; 与乙酸发生酯化反应生成阿司匹林(
与乙酸发生酯化反应生成阿司匹林( ),
),
(1)通过以上分析知,X分子式为C7H8,故答案为:C7H8;
(2) 中官能团的名称为酚羟基和羧基,故答案为:酚羟基、羧基;
中官能团的名称为酚羟基和羧基,故答案为:酚羟基、羧基;
(3)反应③的反应类型是还原反应,通过以上分析知,E的结构简式为 ,故答案为:还原反应;
,故答案为:还原反应; ;
;
(4)邻氨基苯甲酸在一定条件下反应生成Y,反应④的化学方程式为n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O,
+(n-1)H2O,
故答案为:n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O;
(5)阿司匹林同分异构体满足下列条件:①含有苯环;②既不能发生水解反应,也不能发生银镜反应,说明不含酯基和醛基;③1mol该有机物能与2molNaHCO3完全反应,说明含有两个羧基,
如果取代基为-COOH、-CH2COOH,有邻间对3种结构;
如果取代基为-CH(COOH)2,有1种结构;
如果取代基为两个-COOH、一个-CH3,两个-COOH为相邻位置,有2种同分异构体;
如果两个-COOH为相间位置,有3种同分异构体;
如果两个-COOH为相对位置,有1种同分异构体;
所以符合条件的有10种,
故答案为:10;
(6) 在催化剂条件下发生加成反应生成
在催化剂条件下发生加成反应生成 ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成 ,与氯气发生加成反应生成
,与氯气发生加成反应生成 ,最后在氢氧化钠水溶液中发生水解反应生成
,最后在氢氧化钠水溶液中发生水解反应生成 ,合成反应流程图为:
,合成反应流程图为: ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及合成路线设计能力,明确官能团及其性质关系、反应条件是解本题关键,难点是合成路线设计,可以采用正向或逆向方法进行设计,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于稀硫酸中:Al+2H+═Al3++H2↑ | |
| B. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氢氧化铝中和胃酸:OH-+H+═H2O | |
| D. | 少量Cl2通入KI溶液中:Cl2+2I-═2Cl-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈紫色 | |
| B. | 溶液呈黄色 | |
| C. | 上层溶液接近无色,下层溶液呈紫红色 | |
| D. | 上层溶液呈紫红色,下层溶液呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | VA=0.15 mol•L-1•min-1 | B. | VB=0.6 mol•L-1•min-1 | ||
| C. | VC=0.4 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com