
科目:高中化学 来源: 题型:
下列叙述中能肯定说明金属A比金属B活泼的是
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多
D.常温时,A能从酸中置换出氢,而B不能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列结论正确的是( )
①微粒半径S2->Cl>S>F ②氢化物的稳定性HF>HCl>H2S>H2Te
③还原性S2->Cl->Br->I- ④氧化性Cl2>S>Se>Te
⑤酸性H2SO4>HClO4>H2SeO4 ⑥非金属性F>Cl>S>Se
A.只有① B.①③④
C.②④⑥ D.只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
2011年3月,日本发生特大地震,造成福岛核电站放射性核素 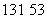 I的泄漏。下列有关
I的泄漏。下列有关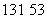 I的叙述错误的是
I的叙述错误的是
A.电子数为78 B.质子数为53 C.中子数为78 D.质量数为131
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中的每个字母代表一种短周期元素。
下表是元素周期表的一部分,表中的每个字母代表一种短周期元素。
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | g | f |
(1)a元素和c元素可以形成的气体,其化学式为 ;
(2)e的元素符号是 ;
(3)b元素原子的最外层电子数为 ;
(4)b、c、d三种元素的非金属性逐渐 (填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d H2f (填“大于”或“小于”)。
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是 ,酸性最强的是 ,既有酸性又有碱性的是 (写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。该电池中,负极材料是______,正极反应式为_______。
Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如下图所示。
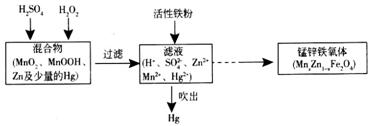
请回答下列问题:
(1).MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为__________。
(2)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如下图所示。
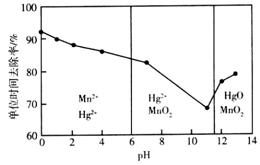
 ①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式___________。
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式___________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4;溶液的氧化性增强外,还可能是___________。
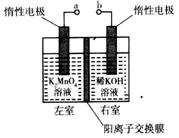
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如右图所示。
①a应接直流电源的____________(填“正”或“负”)极。
②已知25℃,两室溶液的体积均为100 mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得_______mol KMnO4 (忽略溶液的体积和温度变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关溴乙烷的下列叙述中,正确的是( )
A.在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成
B.溴乙烷不溶于水,能溶于大多数有机溶剂
C.溴乙烷与NaOH的醇溶液反应,可生成乙醇
D.溴乙烷通常用溴水与乙烷直接反应来制取
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸晶体的组成可表示为H2C2O4•xH2O.实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4•xH2O  CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.
CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.
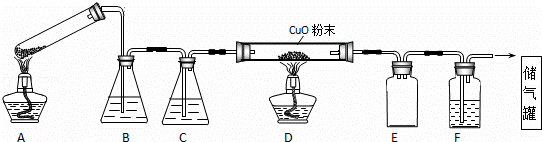
(1)A装置为加热分解草酸的装置,该装置错误是 试管口应向上倾斜(或应向下倾斜) ,C装置中盛放的试剂是 浓硫酸 (填化学式),E装置的作用是 安全瓶(或防倒吸) .
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯.这4步操作由先到后的顺序为 ①③④② (填序号).点燃D处酒精灯前必须要进行的操作名称是 验纯 .
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值.
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL.滴定时,所发生的反应为:2MnO4﹣+5H2C2O4+6H+=10CO2+2Mn2++8H2O.
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有 100mL容量瓶、胶头滴管 .
②x= 1.5 .
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
则x= 2 ,y= 4 .能够得出催化剂对该反应有影响结论的实验现象是 加入MnSO4固体的试管中溶液褪色速率比未加的快 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com