
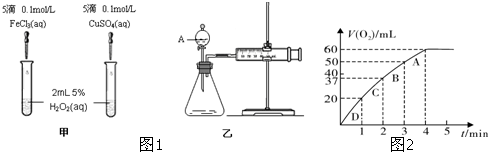
| 1 |
| 3 |
| n |
| V |
| △c |
| △t |
| 1 |
| 3 |
| 1 |
| 2 |
| ||
| 2mol×0.06L |
| 22.4L |
| 0.0054mol |
| 0.05L |
| △c |
| △t |
| △c |
| △t |


科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、a<b |
| C、物质B的质量分数增加 |
| D、物质A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用浓盐酸跟二氧化锰反应制取Cl2 |
| B、用浓氨水和生石灰制取NH3 |
| C、用电石跟水反应制取C2H2 |
| D、用浓硝酸跟铜反应制取NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
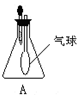 使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )
使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )| A、Cl2和饱和食盐水 |
| B、NO和水 |
| C、O2和水 |
| D、SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com