

| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
分析 己单质在暗处与H2剧烈化合并发生爆炸,则己为F元素,由元素在周期表中的位置,可知戊为He、庚为Ar、辛为Br,由于甲是IA族元素,乙与己同周期,则甲为H、乙为Be、丙为Na、丁为Ca.
A.同主族从上到下金属性增强,同周期自左而右金属性减弱,根据金属活动顺序表判断钠与Ca的金属性强弱;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大;
C.氧化钠只含有离子键;
D.由周期性可知,丁和乙的原子核外电子数相差为第二、三周期容纳元素种数,己和辛的原子核外电子数相差为第三、四周期容纳元素种数.
解答 解:己单质在暗处与H2剧烈化合并发生爆炸,则己为F元素,由元素在周期表中的位置,可知戊为He、庚为Ar、辛为Br,由于甲是IA族元素,乙与己同周期,则甲为H、乙为Be、丙为Na、丁为Ca.
A.同主族从上到下金属性增强,同周期自左而右金属性减弱,由金属活动顺序表可知Ca的金属性比Na强,则金属性:丁>丙>乙,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,则原子半径为:丁>丙>乙>己,故B正确;
C.氧化钠只含有离子键,故C错误;
D.由周期性可知,丁和乙的原子核外电子数相差为第二、三周期容纳元素种数,二者原子序数相差8+8=16,己和辛的原子核外电子数相差为第三、四周期容纳元素种数,二者原子序数相差8+18=26,故D正确,
故选BD.
点评 本题考查本题考查位置结构性质的综合应用,注意对元素周期表与元素周期律掌握,理解同主族元素族序数关系.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
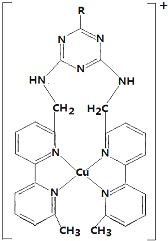 碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍.
碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍. 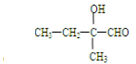 .
.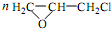 +CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$
+CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$ +nHCl
+nHCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释与说明 |
| A | 苹果放在空气中久置变黄和纸张久置变黄 | 二者变黄的原理相似 |
| B | 用四氯化碳进行衣服的干洗 | 目的是节约用水 |
| C | 钢铁制品和铜制品在空气中被腐蚀 | 二者既能发生吸氧腐蚀又能发生析氢腐蚀 |
| D | 形成黄河入海口沙洲、用卤水点豆腐 | 都体现了胶体聚沉的性质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 在0.1mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 得到NaCl晶体 |
| D | 亚硫酸钡固体加入盐酸,有二氧化硫气体生成 | 盐酸的酸性强于亚硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| B. | 聚氯乙烯塑料有毒,不可用于制食品包装袋 | |
| C. | 明矾溶于水生成的Al (OH)3胶体,可除去水中的悬浮颗粒等杂质 | |
| D. | 新制的Cu(OH)2可以测定糖尿病患者尿中萄葡糖的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 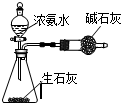 此图:制少量干燥的NH3 | |
| B. | 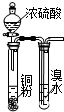 此图:验证浓硫酸具有强氧化性 | |
| C. | 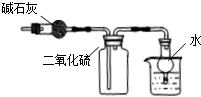 此图:干燥、收集并吸收多余SO2 | |
| D. | 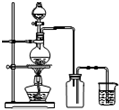 此图:实验室用MnO2和浓盐酸制取Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com