

| A. | ①③④ | B. | ①④ | C. | ②③⑤ | D. | 除② |
分析 ①氢化钠为离子化合物,由钠离子与氢负离子构成;
②乙烯的结构式中C-H不能省略;
③水分子为V型结构;
④硫原子最外层有6个电子,3s轨道上有2个,3d轨道上有4个;
⑤氟化铵为离子化合物.
解答 解:①氢化钠为离子化合物,由钠离子与氢负离子构成,电子式为Na+[:H]-,故正确:
②乙烯的结构式中C-H不能省略,乙烯的结构式为: ,故错误;
,故错误;
③水分子的球棍模型: ,故错误;
,故错误;
④硫原子的外围电子排布式为3s23p4,故正确;
⑤氟化铵为离子化合物,不存在分子式,其化学式为:NH4F,故错误;
故选:B.
点评 本题考查了常见化学用语的使用,熟悉电子式、结构式、原子的外围电子排布式、球棍模型、分子式的表示方法及注意事项是解题关键,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
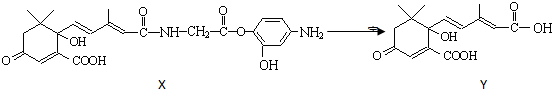 ( )
( )| A. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| B. | 1 molY与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 1 molX最多能加成9 molH2 | |
| D. | X可以发生氧化、取代、酯化、加聚、缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收Cl2:Cl2+2OH-=2Cl-+H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- | |
| D. | 向NaHCO3-溶液中加入澄清石灰水:HCO+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰中存在极性键、非极性键、范德华力、氢键 | |
| B. | MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大 | |
| C. | 等质量的金刚石晶体和石墨晶体含有的碳碳σ键数目相同 | |
| D. | 干冰的晶胞中CO2分子数目和金属铜的晶胞中Cu原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
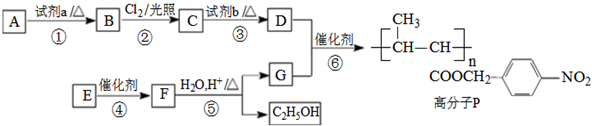
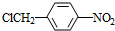 .
.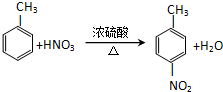 .
.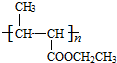 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$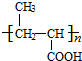 +n CH3CH2OH.
+n CH3CH2OH.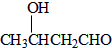 以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
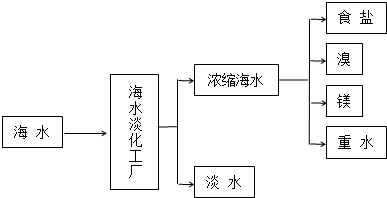
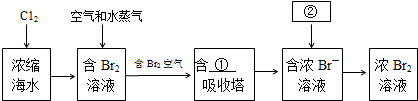
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于硝酸,电子转移数为3NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状态下,22.4L氟化氢中含有氟原子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com