
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性;
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为16.0g;
③加热,开始反应,直到不再有气体产生为止;
④测量排入量筒中水的体积为284.3mL,换算成标准状况下氧气的体积为279.0mL;
⑤准确称量试管和残留物的质量为15.6g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?______.
(2)以下是测量收集到气体体积必须包括的几个步骤: ①调整量筒的高度使广口瓶和量筒内的液面高度相同;②使试管和广口瓶内气体都冷却至室温;③读取量筒内液体的体积,这三步操作的正确顺序是___________________________(请填写步骤代号),进行③的实验操作时,若仰视读数,则读取氧气的体积_______________(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是___________________mol;实验测得氧气的气体摩尔体积是____________L/mol(列出算式即可)。
【答案】往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气 ②①③ 偏小 0.0125 22.32L/mol
【解析】
(1)检查装置的气密性的方法是往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气;
(2)在测量气体的体积之前应先冷却气体,然后调节液面,使之与外界压强相等,则应按以下顺序操作: ②使试管和广口瓶内气体都冷却至室温;①调整量筒的高度使广口瓶和量筒内的液面高度相同;③读取量筒内液体的体积,故序号是②①③;进行③的实验操作时,若仰视读数,由于量筒的小刻度在下,大刻度在上,所以读取氧气的体积偏小;故答案为:②①③、偏小;
(3)实验过程中产生氧气的物质的量是(16.0 g-15. 6 g)÷32g/mol=0.0125mol,实验测得氧气的气体摩尔体积是Vm=V÷n=0.2790L÷0.0125mol= 22.32 L/mol;故答案为:0.0125、22.32L/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下CH3COOH的电离常数为1.7×10-5,该温度下用0.1mol·L-1的醋酸溶液滴定10.00mL等物质的量浓度的碱ROH,滴定过程中加入醋酸的体积(V)与溶液中![]() 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是
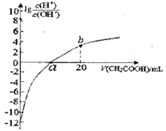
A. b点溶液显碱性
B. a>10.00
C. ROH的电离方程式为ROH![]() R++OH-
R++OH-
D. 25℃时,1mol·L-1的醋酸溶液中CH3COO-的浓度约为4.12×10-2mol·L-1(已知![]() =4.12)
=4.12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A. 7.4 g NH4F和5.6 g C2H4含有的氢原子数均为0.8NA
B. 0.5 L 1 mol/L NaHSO3溶液中含有的HSO3-数目为0.5NA
C. 标准状况下,11.2 L NO2完全溶于水,转移的电子数为0.5NA
D. 在高温高压和催化剂作用的条件下,向一密闭容器中充入28 g N2与足量的H2,充分反应后,转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应:3A(g)+B(g) ![]() xC(g)。
xC(g)。
Ⅰ.将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( )
A. 若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大
B. 若向Ⅰ平衡体系中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C. 若x=2,则Ⅱ体系起始物质的量应满足3n(B) > n(A)+3
D. 若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X)=
(X)= ]。
]。

下列叙述错误的是
A. Ka1(H2A)的数量级为10-2
B. pH=4.2时,c(HA-)=c(A2-)>c(H+)
C. NaHA溶液中,HA-的电离平衡常数大于HA-的水解平衡常数
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+)则![]() (H2A)和
(H2A)和![]() (HA-)一定相等
(HA-)一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com