
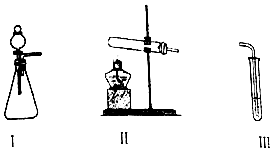
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
分析 ①根据装置Ⅰ不需要加热制取氧气可知利用的是双氧水的分解,然后写出反应的化学方程式;
碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式;
②证明Ⅰ中产生的气体中含有双氧水,氧气和双氧水都具有氧化性,需要利用不同性质进行检验;
③根据甲和乙的实验操作方法及反应现象得出结论;
解答 解:(1)①装置Ⅰ中不能加热,应该选用双氧水的分解,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
Ⅳ中有气泡冒出,溶液变蓝,说明氧气将碘离子氧化成碘单质,反应的离子方程式为:O2+4I-+4H+=2I2+2H2O,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;O2+4I-+4H+=2I2+2H2O;
②a.KMnO4,高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故a正确;
b.FeCl2,氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故b错误;
c.Na2S,高锰酸钾和氧气都能够氧化硫化钠,无法用硫化钠检验混合气体中是否含有双氧水,故c错误;
故答案为:a;
③根据甲再次实验后,由于碘化钾不是在酸性条件下,则溶液没有变蓝,而用硫酸酸化的KI溶液容易变蓝,证明了碘化钾溶液在酸性条件下易被O2氧化,
故答案为:KI溶液在酸性条件下易被O2氧化.
点评 本题考查了物质性质实验方案的设计与评价,题目难度中等,注意掌握实验室中物质的性质实验方案设计的方法,正确理解实验原理及操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 13g 和 和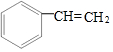 的混合物中含有的电子数为7NA 的混合物中含有的电子数为7NA | |
| B. | 60gSiO2中含有的共价键数目为4NA | |
| C. | 标准状况下,11.2LH2和Cl2反应后得到的气体中含有的原子总数为NA | |
| D. | 1molNaCO3溶于水后,所得溶液中CO32-和HCO3-的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 用石墨电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 向一定量石灰石中滴加稀盐酸 | 向一定量硫酸铜溶液中不断加入铁粉 | 向足量盐酸中加等量的金属Zn、Fe | 向一定量过氧化氢溶液中加入少量二氧化锰 |
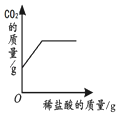 | 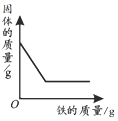 | 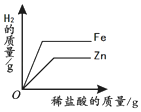 | 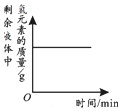 |
| A. | A | B. | B | C. | C | D. | DA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水不能区别酒精、苯和四氯化碳 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 在用水吸收HCl气体时可把导管直接插入液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量的浓硫酸沾到皮肤上时,直接用大量的水冲洗,再涂上稀的NaHCO3溶液 | |
| B. | 为防止试管破裂,加热固体时试管口一般要略低于试管底部 | |
| C. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 | |
| D. | 在盛放浓硫酸的试剂瓶的标签上应印有的警示标记是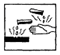 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 5项 | C. | 6项 | D. | 7 项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com