
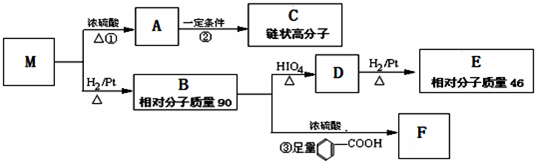

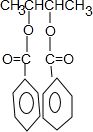
 ,则M为
,则M为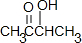 ,M→A是发生的消去反应,A为
,M→A是发生的消去反应,A为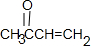 ,A→C发生加成反应,C为
,A→C发生加成反应,C为 .
.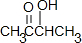 .
.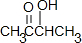 ,分子式为C4H8O2,分子中除羰基外还有羟基,故答案为:C4H8O2;羟基;
,分子式为C4H8O2,分子中除羰基外还有羟基,故答案为:C4H8O2;羟基;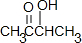 ,根据反应①的反应条件可知,①是消去反应;B为CH3CHOHCHOHCH3据③的反应条件和反应物可知,③为酯化反应,
,根据反应①的反应条件可知,①是消去反应;B为CH3CHOHCHOHCH3据③的反应条件和反应物可知,③为酯化反应,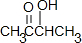 ,结合①的反应条件,M→A是发生的消去反应,羟基和右侧C上的一个H原子消去,生成一个碳碳双键,A→C是加聚反应,反应方程式为:
,结合①的反应条件,M→A是发生的消去反应,羟基和右侧C上的一个H原子消去,生成一个碳碳双键,A→C是加聚反应,反应方程式为: ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、铁跟稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| D、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
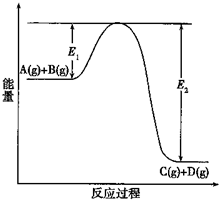 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数越大,原子半径一定越大 |
| B、对同主族元素来说,电子层数多的原子半径比电子层数少的大 |
| C、元素性质周期性变化不是元素性质的简单重复 |
| D、按C、N、O、F的顺序,元素的最高正价依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com