
| m |
| M |
| V |
| Vm |
| N |
| NA |
| mg |
| Mg/mol |
| m |
| M |
| m |
| M |
| m |
| M |
| 4NAm |
| M |
| 4NAm |
| M |
| m |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| mg |
| 1000g+mg |
| m |
| 1000+m |
| m |
| 1000+m |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H═-Q1 2H2(g)+O2(g)=2H2O(g)△H═-Q2 | ||||
| B、S(g)+O2(g)=SO2(g)△H═-Q1 S(s)+O2(g)=SO2(g)△H═-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H═-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
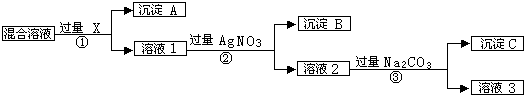
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为CH4O和C2H6O的物质一定互为同系物 |
| B、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| C、苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
| D、2,3一二甲基丁烷的核磁共振氢谱中会出现两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3mol?(L?s)-1 |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
| D、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98mol?L-1,则T1<T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com