
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.反应生成硫酸钡放出热量;
B.加入少量NaHCO3溶液,反应生成碳酸钙、水、NaOH;
C.水解为可逆反应;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H<-57.3kJ/mol,故A错误;
B.向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故B错误;
C.0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红的离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.Na2SO3溶液使酸性KMnO4溶液褪色的离子反应为5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,遵循电子、电荷守恒,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
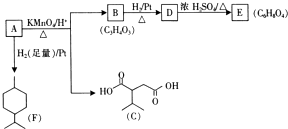
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B3N3H6分子各原子均在同一平面上 | |
| B. | B3N3H6是由极性键组成的均匀而对称的非极性分子 | |
| C. | B3N3H6能发生加成反应和取代反应 | |
| D. | B3N3H6的二氯取代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
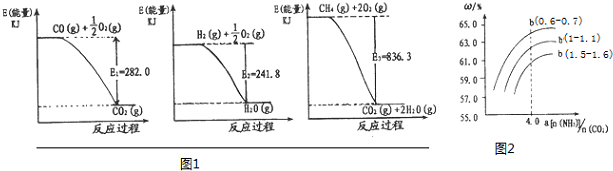
| 时间/S | 0 | 20 | 40 | 60 | 80 |
| N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
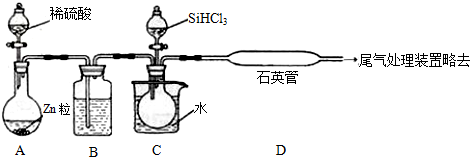
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F- | |
| C. | H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 | |
| D. | 原子堆积模型如图4,可表示Mg原子的堆积方式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com