
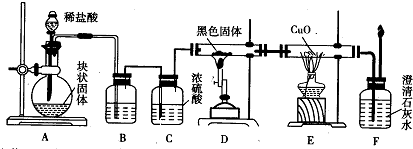
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中. | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+. |
| 步骤2: | |
| 步骤3: | |
| … |
| 实验操作 | 预期现象与结论 |
| 步骤2:在A试管中滴加几滴0.01 mol?L-1KmnO4溶液. | 若紫红色褪去,证明有Fe2+,假设2或假设3成立. |
| 步骤3:在B试管中滴加几滴KSCN溶液. | 若溶液变为血红色,说明有Fe3+,假设1或假设3成立(即既含有二价铁,又含有三价铁);若步骤2、步骤3均有现象,则假设3成立. |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑ |
| B、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | NH4+、Mg2+、Ba2+ |
| 阴离子 | OH-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:
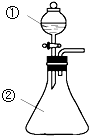 在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是 ( )
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是 ( ) | 选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
| A | 氨水 | 氯化铝溶液 | 产生白色沉淀 |
| B | 浓硫酸 | 铜片 | 产生大量气体,溶液变蓝 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| D | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生大量气体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl2溶液中通入Cl22Fe2++Cl2=2Fe3++2Clˉ |
| B、FeCl3溶液跟过量氨水 Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+ |
| C、碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| D、钠与水的反应 2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
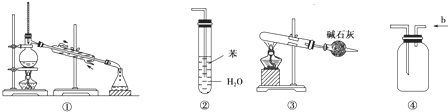
| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com