
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
分析 X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,且Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比氧大,所以Q的电子排布为1s22s22p63s2,即Q为Mg;而G为金属元素,且原子序数介于氧和镁元素之间,所以G为Na;R单质是制造各种计算机、微电子产品的核心材料,则R为Si;T处于周期表的ds区,原子中只有一个未成对电子,价电子排布为3d104s1,故T为Cu.
解答 解:X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,且Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比氧大,所以Q的电子排布为1s22s22p63s2,即Q为Mg;而G为金属元素,且原子序数介于氧和镁元素之间,所以G为Na;R单质是制造各种计算机、微电子产品的核心材料,则R为Si;T处于周期表的ds区,原子中只有一个未成对电子,价电子排布为3d104s1,故T为Cu.
(1)Y为N元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子;T为Cu元素,它的核外电子排布式为:1s22s22p63s23p63d104s1,所以它有7个能级,
故答案为:7;7;
(2)C、N、O位于元素周期表同一周期,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;
OCN-与CO2互为等电子体,所以它们结构相似,OCN-中C原子与O、N原子之比分别形成2对共用电子对,没有孤电子对,所以碳的杂化方式为sp杂化,
故答案为:C<O<N;sp杂化;
(3)Z与R能形成化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O键,所以1mol二氧化硅中含有4molSi-O键;
SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为:4+$\frac{4-1×4}{2}$=4,没有孤对电子,所以SiF4的空间构型为正四面体,
故答案为:4;正四面体形;
(4)在NaF、MgF2、SiF4中,NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点最低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(5)向硫酸铜溶液中逐滴加入氨水溶液至过量,反应生成四氨合铜络离子,反应的离子方程式为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O,
故答案为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O;
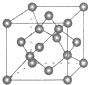
(6)碳单质的晶胞为 ,晶胞中含有C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×$\frac{12}{{N}_{A}}$g,晶体的密度为p g/cm3,则晶胞棱长为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm,则正四面体的棱长为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$,则正四面体的斜高为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$,令斜高为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=b cm,底面中心到边的距离为$\frac{1}{3}$b,设正四面体的高为a cm,则a2+($\frac{1}{3}$b)2=b2,解得a=$\frac{\sqrt{6}}{3}$b,故正四面体中心原子到顶点距离为$\frac{3}{4}$a=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}$b=$\frac{\sqrt{6}}{4}$×$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm,
,晶胞中含有C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×$\frac{12}{{N}_{A}}$g,晶体的密度为p g/cm3,则晶胞棱长为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm,则正四面体的棱长为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$,则正四面体的斜高为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$,令斜高为$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=b cm,底面中心到边的距离为$\frac{1}{3}$b,设正四面体的高为a cm,则a2+($\frac{1}{3}$b)2=b2,解得a=$\frac{\sqrt{6}}{3}$b,故正四面体中心原子到顶点距离为$\frac{3}{4}$a=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}$b=$\frac{\sqrt{6}}{4}$×$\root{3}{\frac{8×\frac{12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm,
故答案为:8;$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及电离能、杂化轨道、分子结构、晶体类型与性质、配合物、晶胞计算等,(6)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,关键理解距离最近碳原子位置.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ②⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
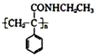
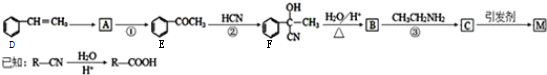
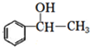 ,②的反应类型为加成反应
,②的反应类型为加成反应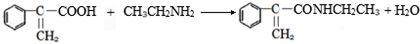
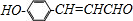 (或
(或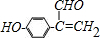 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
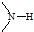 ),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com