
用下图所示实验装置进行相应实验,能达到实验目的是( )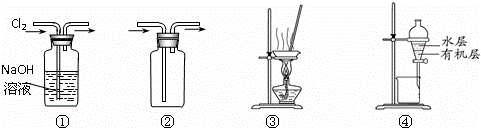
|
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 |
|
| B. | 按装置②所示的气流方向可用于收集H2、NH3等 |
|
| C. | 用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
|
| D. | 用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
| 化学实验方案的评价.. | |
| 专题: | 实验评价题. |
| 分析: | A.二者均与NaOH反应,不符合除杂原则; B.H2、NH3等均可利用向下排空气收集; C.NH4Cl受热易分解,不能利用蒸发得到晶体; D.碘不易溶于水,易溶于四氯化碳. |
| 解答: | 解:A.二者均与NaOH反应,不符合除杂原则,则图中除杂试剂应为饱和食盐水,故A错误; B.H2、NH3等均可利用向下排空气收集,则图中气流方向应从右侧进,故B错误; C.NH4Cl受热易分解,不能利用蒸发得到晶体,应利用冷却热饱和溶液的方法得到晶体,故C错误; D.碘不易溶于水,易溶于四氯化碳,则混合后分层,图中萃取装置合理,故D正确; 故选D. |
| 点评: | 本题考查化学实验方案的评价,为高频考点,涉及气体的收集、除杂及混合物分离提纯方法,把握装置的作用及物质的性质为解答的关键,注意方案的操作性、评价性分析,题目难度不大. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于乙酸的叙述中,不正确的是( )
A.乙酸分子式是C2H4O2,有4个氢原子,不是一元酸
B.乙酸是具有强烈刺激性气味的液体
C.乙酸易溶于水和乙醇
D.鉴别乙酸和乙醇的试剂可以是碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液中c(Cl-)相等的是( )
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 3 mol·L-1 KCl溶液
D.75 mL 3 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中现用Fe与盐酸反应制取2.24 L H2(标准状况下)。
(1)消耗Fe的物质的量为多少?
(2)如果选用所贴标签为2.0 mol·L-1的盐酸,至少需该盐酸多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是( )
|
| A. | 硅单质常用于制造太阳能电池和光纤 |
|
| B. | 石灰石在工业上常用制造水泥和玻璃 |
|
| C. | 碳酸氢钠在医疗上可用于治疗胃酸过多 |
|
| D. | 氧化铝可用于制造耐高温的容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑ |
|
| B. | AlCl3溶液中加入过量的浓氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
|
| C. | 用小苏打治疗胃酸过多:CO32﹣+2H+=H2O+CO2↑ |
|
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究.
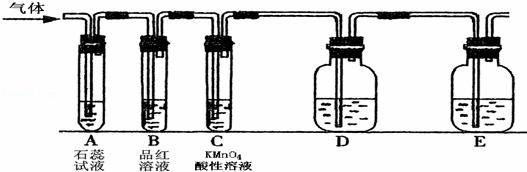
(1)从物质分类的角度,SO2属于 (填“酸性”或“碱性”)氧化物.
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是 .
②当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是 .
(2)从元素化合价的角度分析,SO2具有 性.
①当向该装置通入SO2 一段时间后,可观察C中溶液褪色,说明SO2具有 性,反应的化学方程式为 .
②如验证SO2还具有另一方面的性质,可选择的药品是 .
A.过氧化氢 B. 浓硫酸 C.氯水 D.硫化钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应式:________________________。
(2)某学生认为,铁电极可能参与反应,并对产物做出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:____________________________________________________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是____________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:________。
Ⅱ.利用如图所示装置做电解50 mL 0.5 mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO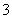 );
);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
①_________________________________________________________;
②_________________________________________________________。
(2)分析实验记录B中浅蓝色固体可能是________(写化学式),试分析生成该物质的原因:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完全沉淀等物质的量浓度的NaCl.MgCl2.AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为
A.1:1:1 B.3:2:1 C.6:3:2 D.9:3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com