
”°½ą¾»Ćŗ¼¼Źõ”±ŃŠ¾æŌŚŹĄ½ēÉĻĻąµ±Ęձ飬æĘŃŠČĖŌ±ĶعżĻņµŲĻĀĆŗ²ćĘų»ÆĀÆÖŠ½»Ģę¹ÄČėæÕĘųŗĶĖ®ÕōĘųµÄ·½·Ø£¬Į¬Šų²ś³öĮĖøßČČÖµµÄĆŗĢæĘų£¬ĘäÖ÷ŅŖ³É·ÖŹĒCOŗĶH2”£COŗĶH2æÉ×÷ĪŖÄÜŌ“ŗĶ»Æ¹¤ŌĮĻ£¬Ó¦ÓĆŹ®·Ö¹ć·ŗ”£Éś²śĆŗĢæĘųµÄ·“Ó¦Ö®Ņ»ŹĒ£ŗC(s)+H2O(g)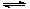 CO(g)+H2(g)?131.4 kJ”£
CO(g)+H2(g)?131.4 kJӣ
£Ø1£©ŌŚČŻ»żĪŖ3LµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬5minŗóČŻĘ÷ÄŚĘųĢåµÄĆܶČŌö“óĮĖ0.12g£ÆL£¬ÓĆH2O±ķŹ¾0”«5miinµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ_________________________”£
£Ø2£©ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ________£ØŃ”Ģī±ąŗÅ£©”£
a£®vÕż (C)= vÄę(H2O) b£®ČŻĘ÷ÖŠCOµÄĢå»ż·ÖŹż±£³Ö²»±ä
c£®c(H2)=c(CO) d£®ĢæµÄÖŹĮæ±£³Ö²»±ä
£Ø3£©ČōÉĻŹö·“Ó¦ŌŚt0Ź±æĢ“ļµ½Ę½ŗā(ČēĶ¼)£¬ŌŚt1Ź±æĢøıäijŅ»Ģõ¼ž£¬ĒėŌŚÓŅĶ¼ÖŠ¼ĢŠų»³öt1Ź±æĢÖ®ŗóÕż·“Ó¦ĖŁĀŹĖꏱ¼äµÄ±ä»Æ£ŗ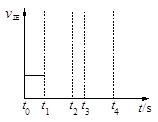
¢ŁĖõŠ”ČŻĘ÷Ģå»ż£¬t2Ź±µ½“ļĘ½ŗā(ÓĆŹµĻß±ķŹ¾)£»
¢Śt3Ź±Ę½ŗā³£ŹżKÖµ±ä“ó£¬t4µ½“ļĘ½ŗā(ÓĆŠéĻß±ķŹ¾)”£
£Ø4£©ŌŚŅ»¶ØĢõ¼žĻĀÓĆCOŗĶH2¾ČēĻĀĮ½²½·“Ó¦ÖĘµĆ¼×Ėį¼×õ„£ŗ
¢ŁCO(g) + 2H2(g)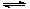 CH3OH(g) ¢ŚCO(g) + CH3OH(g)
CH3OH(g) ¢ŚCO(g) + CH3OH(g)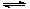 HCOOCH3(g)
HCOOCH3(g)
¢Ł·“Ó¦¢ŁÖŠCOµÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŌŚ²»øı䷓ӦĪļÓĆĮæµÄĒéæöĻĀ£¬ĪŖĢįøßCOµÄ×Ŗ»ÆĀŹæɲÉČ”µÄ“ėŹ©ŹĒ ”£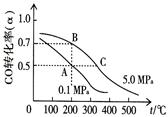
¢ŚŅŃÖŖ·“Ó¦¢ŁÖŠCOµÄ×Ŗ»ÆĀŹĪŖ80%£¬·“Ó¦¢ŚÖŠĮ½ÖÖ·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ¾łĪŖ85%£¬Ōņ5.04kgCO×ī¶ąæÉÖĘµĆ¼×Ėį¼×õ„ kg”£
(±¾Ģā¹²10·Ö)£Ø1£©0.002mol/(L”¤min)(2·Ö) £Ø2£©b”¢d(2·Ö)
£Ø3£©£ØĶ¼ĀŌ£¬ŗĻĄķøų·Ö£©¢Łt1Ź±Ķ»ŌöµÄuÕż½„ŌöÖĮt2Ź±±£³Ö²»±ä£»¢Śt3Ź±Ķ»ŌöµÄuÕż½„¼õÖĮt4Ź±±£³Ö²»±ä(ø÷1·Ö)
£Ø4£©¢Ł½µĪĀ”¢¼ÓŃ¹£»½«¼×“¼“Ó»ģŗĻĢåĻµÖŠ·ÖĄė³öĄ“(2·Ö)¢Ś4.08(2·Ö)
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©5minŗóČŻĘ÷ÄŚĘųĢåµÄĆܶČŌö“óĮĖ0.12g£ÆL£¬Ņņ“ĖĘųĢåµÄÖŹĮæŌö¼ÓĮĖ0.12g/L”Į3L£½0.36g£¬øł¾Ż·½³ĢŹ½æÉÖŖ£ŗC(s)+H2O(g) CO(g)+H2(g) ”÷m”ü
CO(g)+H2(g) ”÷m”ü
1mol 12g
0.03mol 0.36g
ĖłŅŌĻūŗÄĖ®ÕōĘųµÄĪļÖŹµÄĮæÅØ¶ČŹĒ0.03mol”Ā3L£½0.01mol/L£¬Ņņ“ĖÓĆH2O±ķŹ¾0”«5miinµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.01mol/L”Ā5min£½0.002mol/(L”¤min)”£
£Ø2£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±æÉÄę·“Ó¦µÄÕż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹĻąµČŹ±£Øµ«²»ĪŖ0£©£¬·“Ó¦ĢåĻµÖŠø÷ÖÖĪļÖŹµÄÅØ¶Č»ņŗ¬Įæ²»ŌŁ·¢Éś±ä»ÆµÄדĢ¬£¬³ĘĪŖ»ÆŃ§Ę½ŗāדĢ¬”£a£®Ģ¼ŹĒ¹ĢĢ壬²»ÄÜÓĆĄ“±ķŹ¾£¬a²»ÕżČ·£»b£®ČŻĘ÷ÖŠCOµÄĢå»ż·ÖŹż±£³Ö²»±ä£¬ĖµĆ÷·“Ó¦µĆµ½Ę½ŗāדĢ¬£¬bÕżČ·£»c£®c(H2)=c(CO)£¬µ«Ć»ÓŠÖøĆ÷·“Ó¦µÄ·½Ļņ£¬ĖłŅŌæÉÄę·“Ó¦²»Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£¬c²»ÕżČ·£»d£®ĢæµÄÖŹĮæ±£³Ö²»±ä£¬ĖµĆ÷ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬dÕżČ·£¬“š°øŃ”bd”£
£Ø3£©¢ŁĖõŠ”ČŻĘ÷Ģå»ż£¬Ń¹ĒæŌö“󣬷“Ó¦ĖŁĀŹŌö“ó”£Õż·½Ó¦ŹĒĢå»żŌö“óµÄæÉÄę·“Ó¦£¬ĖłŅŌĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬¼“Õż·“Ó¦ĖŁĀŹÖš½„Ōö“󵽊æĘ½ŗā£¬Ņņ“ĖĒśĻßæÉŅŌ±ķŹ¾ĪŖ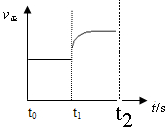 ”£
ӣ
¢Śt3Ź±Ę½ŗā³£ŹżKÖµ±ä“ó£¬ĖµĆ÷Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£Õż·½Ó¦ŹĒĪüČČ·“Ó¦£¬ĖłŅŌøıäµÄĢõ¼žŹĒÉżøßĪĀ¶Č£¬Ņņ“ĖÕż·“Ó¦ĖŁĀŹŌö“ó£¬Č»ŗóÖš½„¼õŠ”µ½ŠĀĘ½ŗāדĢ¬£¬ĖłŅŌĒśĻßæÉŅŌ±ķŹ¾ĪŖ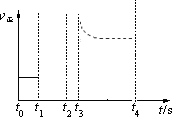 ”£
ӣ
£Ø4£© ¢Łøł¾ŻĶ¼ĻńæÉÖŖ£¬ŌŚŃ¹ĒæĻąĶ¬Ź±£¬ĪĀ¶ČŌ½øߣ¬COµÄ×Ŗ»ÆĀŹŌ½µĶ£¬ÕāĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬Ņņ“ĖÕż·½Ó¦ŹĒ·ÅČČ·“Ó¦”£ĪĀ¶ČĻąĶ¬Ź±£¬Ń¹ĒæŌ½“ó£¬COµÄ×Ŗ»ÆĀŹŌ½øߣ¬ĖłŅŌĪŖĢįøßCOµÄ×Ŗ»ÆĀŹæɲÉČ”µÄ“ėŹ©ŹĒ½µĪĀ”¢¼ÓŃ¹»ņ½«¼×“¼“Ó»ģŗĻĢåĻµÖŠ·ÖĄė³öĄ“”£
¢Ś5.04kgCOµÄĪļÖŹµÄĮæŹĒ5040g”Ā28g/mol£½180mol”£Éč²Ī¼Ó·“Ó¦¢ŁµÄCOĪļÖŹµÄĮæŹĒx£¬Ōņ²Ī¼Ó·“Ó¦¢ŚµÄCOĪļÖŹµÄĮæŹĒ180mol£x”£·“Ó¦¢ŁÖŠCOµÄ×Ŗ»ÆĀŹĪŖ80%£¬Ōņ·“Ó¦ÖŠÉś³ÉµÄ¼×“¼ĪļÖŹµÄĮæŹĒ0.8x”£ŌŚ·“Ó¦¢ŚÖŠĮ½ÖÖ·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ¾łĪŖ85%£¬Ōņ0.8x”Į0.85£½(180mol£x)”Į0.85£¬½āµĆx£½100mol£¬ĖłŅŌŹµ¼ŹÉś³ÉµÄ¼×Ėį¼×õ„µÄĪļÖŹµÄĮæŹĒ0.8x”Į0.85£½68mol£¬ĘäÖŹĮæŹĒ68mol”Į60g/mol£½4080g£½4.08kg”£
æ¼µć£ŗæ¼²éæÉÄę·“Ó¦Ę½ŗāדĢ¬ÅŠ¶Ļ”¢Ķā½ēĢõ¼ž¶ŌĘ½ŗāדĢ¬ŗĶ·“Ó¦ĖŁĀŹµÄÓ°ĻģŅŌ¼°·“Ó¦ĖŁĀŹŗĶ²śĀŹµÄÓŠ¹Ų¼ĘĖćµČ


 Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
300”ꏱ£¬½«2mol AŗĶ2mol BĮ½ÖÖĘųĢå»ģŗĻÓŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ3A(g)+B(g) 2C(g)+2D(g) ”÷H£¬2minÄ©“ļµ½Ę½ŗā£¬Éś³É0.8mol D”£
2C(g)+2D(g) ”÷H£¬2minÄ©“ļµ½Ę½ŗā£¬Éś³É0.8mol D”£
(1)ŌŚ2minÄ©Ź±£¬AµÄĘ½ŗāÅضČĪŖ_____________£¬BµÄ×Ŗ»ÆĀŹ___________£¬0-2minÄŚDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ_____________”£
(2)øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗK=_____________”£øĆĪĀ¶ČĻĀµÄ»ÆŃ§Ę½ŗā³£ŹżŹżÖµĪŖ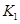 =____________”£
=____________ӣ
ŅŃÖŖ350”ꏱ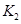 =l£¬Ōņ”÷H________0£ØĢī”°>”±»ņ”°<”±£©”£
=l£¬Ōņ”÷H________0£ØĢī”°>”±»ņ”°<”±£©”£
(3)ŌŚ300”ꏱ£¬½«øĆ·“ӦȯĘ÷Ń¹ĖõĢå»żĪŖlL”£ŌņAµÄ×Ŗ»ÆĀŹ___________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£¬ŌŅņŹĒ__________________”£øĆĢõ¼žĻĀµÄĘ½ŗā³£ŹżĪŖ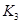 ”£ ŌņK3________
”£ ŌņK3________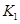 £¬£ØĢī”°<”±»ņ”°>”±»ņ”°=”±£©”£ŌŅņŹĒ_______________________”£
£¬£ØĢī”°<”±»ņ”°>”±»ņ”°=”±£©”£ŌŅņŹĒ_______________________”£
(4)ÄÜÅŠ¶ĻøĆ·“Ó¦ŹĒ·ń“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ__________________£Ø¶ąŃ”æŪ·Ö£©”£
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠc(A)²»±ä
C£®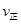 (A)=
(A)=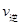 (C) D£®»ģŗĻĘųĢåĆÜ¶Č²»±ä
(C) D£®»ģŗĻĘųĢåĆÜ¶Č²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚŅ»¹Ģ¶ØČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molµÄN2ŗĶ0.6molµÄH2£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2(g)£«3H2(g) 2NH3(g) ”÷H£¼0 ”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĻĀĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3(g) ”÷H£¼0 ”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĻĀĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ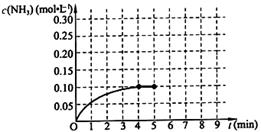
øł¾ŻĶ¼£¬¼ĘĖć“Ó·“Ó¦æŖŹ¼µ½Ę½ŗāŹ±£¬Ę½¾ł·“Ó¦ĖŁĀŹv(NH3)= ”£
¢ĘĻĀĮŠĆčŹöÖŠÄÜĖµĆ÷ÉĻŹö·“Ó¦ŅŃ“ļĘ½ŗāµÄŹĒ ”£
| A£®3vÕż£ØH2£©£½2vÄę£ØNH3£© |
| B£®ČŻĘ÷ÖŠĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓĮæ²»Ėꏱ¼ä¶ų±ä»Æ |
| C£®ČŻĘ÷ÖŠĘųĢåµÄĆÜ¶Č²»Ėꏱ¼ä¶ų±ä»Æ |
| D£®ČŻĘ÷ÖŠĘųĢåµÄ·Ö×Ó×ÜŹż²»Ėꏱ¼ä¶ų±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĪļµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ唣NO2æÉÓĆĻĀĮŠ·“Ó¦Ą““¦Ąķ£ŗ
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q£ØQ£¾0£©”£
7N2(g)+12H2O(g)+Q£ØQ£¾0£©”£
Ķź³ÉĻĀĮŠĢīæÕ£ŗ
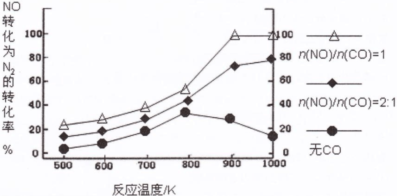
£Ø1£©·“Ó¦µÄĘ½ŗā³£Źż“󣬓¦ĄķNO2µÄŠ§ĀŹøß”£Ōö“óøĆ·“Ó¦Ę½ŗā³£ŹżµÄ“ėŹ©ÓŠ ”£
£Ø2£©Ņ»¶ØĢõ¼žĻĀÉĻŹö·“Ó¦ŌŚÄ³Ģå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ ”£
a£®c(NO2)£ŗc(NH3) = 3£ŗ4 b£®6v(NO2) = 7v(N2)
c£®ČŻĘ÷ÄŚĘųĢå×ÜŃ¹Ēæ²»ŌŁ±ä»Æ d£®ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»ŌŁ±ä»Æ
£Ø3£©ČōĘ½ŗāŹ±NO2ŗĶN2µÄÅضČÖ®±ČĪŖm/n£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ĖõŠ”·“ӦȯĘ÷µÄĢå»żŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±NO2ŗĶN2µÄÅضČÖ®±Č m/n£ØĢī”°>”±”¢”°=”±»ņ”°<”±£©”£
£Ø4£©Ä³ĪĀ¶ČĻĀ£¬ŌŚŅ»øöČŻ»żĪŖ2ÉżµÄ·“ӦȯĘ÷ÄŚ£¬ÉĻŹö·“Ó¦2·ÖÖÓŗó“ļµ½Ę½ŗā£¬²āµĆøÕŗĆÓŠ3molµē×Ó·¢Éś×ŖŅĘ£¬ŌņŌŚ2·ÖÖÓÄŚNH3µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗ
v(NH3) = ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
½šŹōĪŁÓĆĶ¾¹ć·ŗ£¬Ö÷ŅŖÓĆÓŚÖĘŌģÓ²ÖŹ»ņÄĶøßĪĀµÄŗĻ½š£¬ŅŌ¼°µĘÅŻµÄµĘĖ攣øßĪĀĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠÓĆH2»¹ŌWO3æɵƵ½½šŹōĪŁ£¬Ęä×Ü·“Ó¦ĪŖ£ŗ
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
W (s) + 3H2O (g) Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚŅ»¶ØĪĀ¶ČĻĀ½ųŠŠÉĻŹö·“Ó¦£¬Čō·“ӦȯĘ÷µÄČŻ»żĪŖ0£®5 L£¬2minŗó“ļµ½Ę½ŗā£¬²āµĆ¹ĢĢåµÄÖŹĮæ¼õÉŁĮĖ4£®80 g£¬ŌņH2µÄĘ½¾ł·“Ó¦ĖŁĀŹ_________£»øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=___________
£Ø2£©Ä³ĪĀ¶ČĻĀ·“Ó¦“ļĘ½ŗāŹ±£¬H2ÓėĖ®ÕōĘųµÄĢå»ż±ČĪŖ2:3£¬ŌņH2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ__________£»ĖęĪĀ¶ČµÄÉżøߣ¬H2ÓėĖ®ÕōĘųµÄĢå»ż±Č¼õŠ”£¬ŌņøĆ·“Ó¦ĪŖ ____£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£© ·“Ó¦”£
£Ø3£©Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬ÄܱķŹ¾ÉĻŹö·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ________”£
A£®»ģŗĻĘųĢåµÄ×ÜŃ¹Ēæ±£³Ö²»±ä B£®vÕż(H20)= vÕż(H2)
C£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä D£®»ģŗĻĘųĢåµÄĘ½¾łŹ½Įæ±£³Ö²»±ä
£Ø4£©ĪŁĖæµĘ¹ÜÖŠµÄWŌŚŹ¹ÓĆ¹ż³ĢÖŠ»ŗĀż»Ó·¢£¬Ź¹µĘĖæ±äĻø£¬¼ÓČėI2æÉŃÓ³¤µĘ¹ÜµÄŹ¹ÓĆŹŁĆü£¬Ę乤×÷ŌĄķĪŖ£ŗW (s) +2I2 (g) 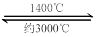 WI4 (g)”£ĻĀĮŠĖµ·ØÕżČ·µÄÓŠ__________”£
WI4 (g)”£ĻĀĮŠĖµ·ØÕżČ·µÄÓŠ__________”£
A£®ĪĀ¶ČÉżøߏ±£¬WI4µÄ·Ö½āĖŁĀŹ¼Óæģ£¬WŗĶI2µÄ»ÆŗĻĖŁĀŹ¼õĀż
B£®WI4ŌŚµĘĖæÉĻ·Ö½ā£¬²śÉśµÄWÓÖ³Į»żŌŚµĘĖæÉĻ
C£®WI4ŌŚµĘ¹Ü±ŚÉĻ·Ö½ā£¬Ź¹µĘ¹ÜµÄŹŁĆüŃÓ³¤
D£®µĘ¹ÜÄŚµÄI2æÉŃ»·Ź¹ÓĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©³£ĪĀĻĀ£¬½«2ÖÖŅ»ŌŖĖį·Ö±šŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ŹµŃ鏿¾ŻČēĻĀ£ŗ
| ×鱚 | Ņ»ŌŖĖį | NaOH | pH |
| ¼× | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| ŅŅ | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
 CH3OH(g) ”÷H
CH3OH(g) ”÷H| ĪĀ¶Č | 523K | 573K | 623K |
| Ę½ŗā³£Źż(K) | 2.041 | 0.270 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÓĆ»Æѧ·“Ó¦ŌĄķĻą¹ŲÖŖŹ¶Ķ¬“š
I£®øł¾ŻĻĀ±ķĖłŹ¾»Æѧ·“Ó¦ÓėŹż¾Ż¹ŲĻµ»Ų“šĻĀĮŠĪŹĢā£ŗ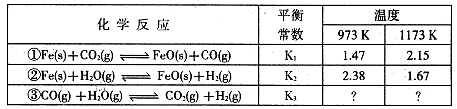
£Ø1£©·“Ó¦¢ŁŹĒ £ØĢī”°ĪüČČ"»ņ”°·ÅČČ”±£©·“Ó¦”£
£Ø2£©øł¾Ż·“Ó¦¢ŁÓė¢ŚæÉĶʵ¼³öĶ¬ĪĀĻĀK1”¢K2ÓėK3Ö®¼äµÄ¹ŲĻµ£¬ŌņK3= £ØÓĆK1”¢K2±ķŹ¾£©”£
£Ø3£©Čō·“Ó¦¢ŪµÄÄę·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ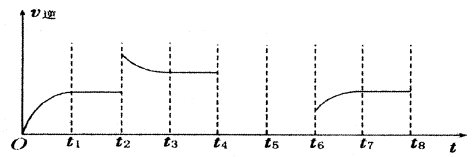
¢Ł·“Ó¦ŌŚt1”¢t3”¢t7Ź±¶¼“ļµ½ĮĖĘ½ŗā£¬Čōt2Ź±Ö»øıäĮĖŅ»ÖÖĶā½ēĢõ¼žjŹŌÅŠ¶Ļ£ŗøıäµÄĢõ¼žæÉÄÜŹĒ ”£
¢ŚČōt4Ź±½µŃ¹£¬t6Ź±Ōö“ó·“Ó¦ĪļµÄÅØ¶Č£¬ĒėŌŚĶ¼ÖŠ»³öt4”«t6Ź±Äę·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµĒśĻß”£
II£®Ēėøł¾Ż“×ĖįµÄµēĄėĘ½ŗā»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©³£ĪĀĻĀ£¬0.1mol£ÆL µÄCH3COOHČÜŅŗÖŠÓŠl£„µÄCH3COOH·Ö×Ó·¢ÉśµēĄė£¬ŌņČÜŅŗµÄpH= ”£
£Ø2£©½«ÉĻŹöČÜŅŗ¼ÓÕōĮóĖ®Ļ”ŹĶ£¬ŌŚĻ”ŹĶ¹ż³ĢÖŠ£¬ĻĀĮŠø÷ĻīÖŠŌö“óµÄŹĒ £ØĢī×ÖÄø±ąŗÅ£©”£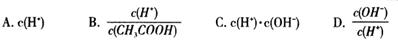
£Ø3£©25”ꏱ£¬CH3COOHµÄµēĄėĘ½ŗā³£ŹżĪŖ1£®75”Į10-5£¬ĻÖ½«Ņ»¶ØĮæµÄCH3COOHÓėNaOHČÜŅŗ»ģŗĻ£¬Čō²āµĆ»ģŗĻŅŗpH=5£®6£¬Ōņ»ģŗĻŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖ2A£Øg£©£«B£Øg£©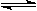 2C£Øg£©£¬ĻņČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė0.050 mol AŗĶ0.025mol B£¬ŌŚ500”ꏱ³ä·Ö·“Ó¦£¬“ļĘ½ŗāŗó²āµĆc£ØC£©="0.040" mol”¤L-1£¬·Å³öČČĮæQ1kJ”£
2C£Øg£©£¬ĻņČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė0.050 mol AŗĶ0.025mol B£¬ŌŚ500”ꏱ³ä·Ö·“Ó¦£¬“ļĘ½ŗāŗó²āµĆc£ØC£©="0.040" mol”¤L-1£¬·Å³öČČĮæQ1kJ”£
¢ÅÄÜĖµĆ÷ÉĻŹö·“Ó¦ŅŃ¾“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ £ØĢīŠ“ŠņŗÅ£©
a.v(C)=2v(B) b.ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
c.vÄę(A)=2vÕż(B) d.ČŻĘ÷ÄŚĘųĢåµÄĆܶȱ£³Ö²»±ä
¢ĘČōŌŚĻąĶ¬µÄČŻĘ÷ÖŠÖ»¼ÓČė0.050 mol C£¬500”ꏱ³ä·Ö·“Ó¦“ļĘ½ŗāŗó£¬ĪüŹÕČČĮæQ2kJ£¬ŌņQ1ÓėQ2Ö®¼äµÄ¹ŲĻµŹ½æɱķŹ¾ĪŖ £ØÓĆŗ¬Q1”¢Q2µÄ“śŹżŹ½±ķŹ¾£©£»
¢Ē500”ꏱ£¬ÉĻŹö·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK= £»
¢ČŅŃÖŖ£ŗK£Ø300”ę£©£¾K£Ø350”ę£©£¬øĆ·“Ó¦ŹĒ £ØĢī”°·Å”±»ņ”°Īü”±£©ČČ·“Ó¦£»Čō·“Ó¦ĪĀ¶ČÉżøߣ¬AµÄ×Ŗ»ÆĀŹ £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£»
¢ÉijĪĀ¶ČĻĀ£¬AµÄĘ½ŗā×Ŗ»ÆĀŹ£Øa£©ÓėĢåĻµ×ÜŃ¹Ēæ£ØP£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬Ę½ŗāדĢ¬ÓÉa±äµ½bŹ±£¬»ÆŃ§Ę½ŗā³£ŹżK£ØA£© K£ØB£©£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
2012Äź8ŌĀ24ČÕ£¬ĪäŗŗŹŠŅ»¼ŅÓŠÉ«½šŹōÖĘŌģ³§·¢Éś°±ĘųŠ¹Ā¶ŹĀ¹Ź”£ŅŃÖŖŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ŗĻ³É°±¹¤ŅµŌĮĻĘųH2ÖʱøÉę¼°ĻĀĆęµÄĮ½øö·“Ó¦£ŗ
C(s)£«H2O(g) CO(g)£«H2(g)£»
CO(g)£«H2(g)£»
CO(g)£«H2O(g) H2(g)£«CO2(g)”£
H2(g)£«CO2(g)”£
(1)ÅŠ¶Ļ·“Ó¦CO(g)£«H2O(g) CO2(g)£«H2(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ________”£(¶ąŃ””¢Ā©Ń””¢“ķŃ”¾ł²»µĆ·Ö)
CO2(g)£«H2(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ________”£(¶ąŃ””¢Ā©Ń””¢“ķŃ”¾ł²»µĆ·Ö)
A£®ČŻĘ÷ÄŚŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠc(CO)²»±ä
C£®vÕż(H2)£½vÄę(H2O) D£®c(CO2)£½c(CO)
(2)ŌŚ2 L¶ØČŻĆܱÕČŻĘ÷ÖŠĶØČė1 mol N2(g)ŗĶ3 mol H2(g)£¬·¢Éś·“Ó¦£ŗ3H2(g)£«N2(g)  2NH3(g)£¬¦¤H£¼0£¬²āµĆŃ¹Ēæ£Ź±¼äĶ¼ĻńČēĶ¼¼×£¬²āµĆp2£½0.6p1£¬“ĖŹ±ĪĀ¶ČÓėĘšŹ¼ĪĀ¶ČĻąĶ¬£¬ŌŚ“ļµ½Ę½ŗāĒ°Ä³Ņ»Ź±æĢ(t1)Čō½öøıäŅ»ÖÖĢõ¼ž£¬µĆµ½ČēŅŅĶ¼Ļń”£
2NH3(g)£¬¦¤H£¼0£¬²āµĆŃ¹Ēæ£Ź±¼äĶ¼ĻńČēĶ¼¼×£¬²āµĆp2£½0.6p1£¬“ĖŹ±ĪĀ¶ČÓėĘšŹ¼ĪĀ¶ČĻąĶ¬£¬ŌŚ“ļµ½Ę½ŗāĒ°Ä³Ņ»Ź±æĢ(t1)Čō½öøıäŅ»ÖÖĢõ¼ž£¬µĆµ½ČēŅŅĶ¼Ļń”£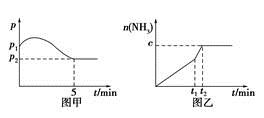
¢ŁČōĶ¼ÖŠc£½1.6 mol£¬ŌņøıäµÄĢõ¼žŹĒ________(Ģī×ÖÄø)£»
¢ŚČōĶ¼ÖŠc£¼1.6 mol£¬ŌņøıäµÄĢõ¼žŹĒ__________(Ģī×ÖÄø)£»“ĖŹ±øĆ·“Ó¦µÄĘ½ŗā³£Źż____________”£(Ģī×ÖÄø)(Ģī”°Ōö“ó”±”¢”°¼õŠ””±”¢”°²»±ä”±)
A£®ÉżĪĀ””””””B£®½µĪĀ””””””C£®¼ÓŃ¹””””””D£®¼õŃ¹””””””E£®¼Ó“߻ƼĮ
(3)Čē(2)ĢāÖŠĶ¼¼×£¬Ę½ŗāŹ±ĒāĘųµÄ×Ŗ»ÆĀŹĪŖ________”£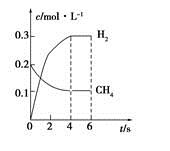
(4)¹¤ŅµÉĻæÉĄūÓĆČēĻĀ·“Ó¦£ŗH2O (g)£«CH4 (g) 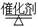 CO(g)£«3H2(g)ÖʱøCOŗĶH2”£ŌŚŅ»¶ØĢõ¼žĻĀ1 LµÄĆܱÕČŻĘ÷ÖŠ³äČė0.3 mol H2OŗĶ0.2 mol CH4£¬²āµĆH2(g)ŗĶCH4(g)µÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆĒśĻßČēÓŅĶ¼ĖłŹ¾£ŗ0”«4 sÄŚ£¬ÓĆCO(g)±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ____________”£
CO(g)£«3H2(g)ÖʱøCOŗĶH2”£ŌŚŅ»¶ØĢõ¼žĻĀ1 LµÄĆܱÕČŻĘ÷ÖŠ³äČė0.3 mol H2OŗĶ0.2 mol CH4£¬²āµĆH2(g)ŗĶCH4(g)µÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆĒśĻßČēÓŅĶ¼ĖłŹ¾£ŗ0”«4 sÄŚ£¬ÓĆCO(g)±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com