
下列说法中正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质不变,质量改变
C.催化剂能改变化学反应速率
D.电解水时,往水中加少量NaOH,可使电解速率明显加快,所以NaOH是这个反应的催化剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
【物质结构与性质】(14分)
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。

查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
有机物X、Y、M(M为乙酸)的转化关系为: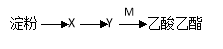 ,下列说法错误的是
,下列说法错误的是
A.X可用新制的氢氧化铜检验
B.反应X→Y中,1molX可生成3molY
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘的四氯化碳溶液检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)4.4金属的电化学腐蚀与防护(解析版) 题型:选择题
钢铁在腐蚀过程中,下列变化可能发生的是( )
①铁元素由+2价转化为+3价
②氧气被还原
③产生氢气
④Fe(OH)3失水生成Fe2O3·xH2O
⑤杂质碳被氧化而除去
A.①②B.③④ C.①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①③⑤B.②⑤ C.②③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:填空题
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

请回答:
(1)写出甲池中正极的电极反应式: 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极 ,总反应的离子方程式为 。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论? (填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法 (填“可靠”或“不可靠”)。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e- Cu
Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:填空题
)以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:填空题
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:
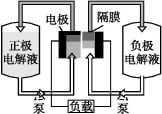
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com