
| A. | 脚气病 | B. | 坏血病 | C. | 夜盲症 | D. | 神经炎 |
科目:高中化学 来源: 题型:选择题
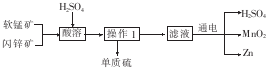
| A. | 酸溶时,ZnS作氧化剂 | B. | 硫酸可以循环使用 | ||
| C. | 可用盐酸代替硫酸进行酸溶 | D. | MnO2和ZnS均属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中:
I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
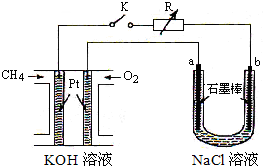 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
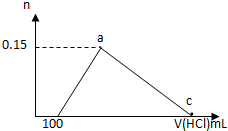 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )| A. | 原AlCl3溶液的物质的量浓度为1.5mol/L | |
| B. | c点的体积为750mL | |
| C. | 原加入的NaOH的物质的量为0.7mol | |
| D. | a和c点间铝元素以AlO2-和Al(OH)3的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2与H2在一定条件下合成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3被O2氧化成NO和H2O | D. | 由NH3制备化肥NH4HCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com