
| A. | 产生气体的质量为0.3g | |
| B. | 合金中镁与铝的物质的量之比为1:2 | |
| C. | 溶液X中剩余NaOH的物质的量为0.2 mol | |
| D. | 向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体15.6 g |
分析 Al与氢氧化钠反应生成氢气,氢气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子转移守恒,Al的物质的量为$\frac{0.3mol×2}{3}$=0.2mol,则Al的质量为0.2mol×27g/mol=5.4g,故Mg的物质的量为$\frac{7.8g-5.4g}{24g/mol}$=0.1mol,由此分析解答.
解答 解:Al与氢氧化钠反应生成氢气,氢气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子转移守恒,Al的物质的量为$\frac{0.3mol×2}{3}$=0.2mol,则Al的质量为0.2mol×27g/mol=5.4g,故Mg的物质的量为$\frac{7.8g-5.4g}{24g/mol}$=0.1mol,
A、氢气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,氢气的质量为:0.3mol×2g/mol=0.6g,故A错误;
B、合金中镁与铝的物质的量之比为0.1:0.2=1:2,故B正确;
C、铝消耗的氢氧化钠的物质的量为0.2mol,溶液X中剩余NaOH的物质的量为0.1×5-0.2=0.3 mol,故C错误;
D、向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体0.1mol的氧化铝和0.25mol的碳酸钠,质量为:0.1×102+0.25×106=36.7g,故D错误;
故选B.
点评 本题考查化学方程式计算、混合物计算,明确发生的反应即可解答,注意利用守恒法不能方程式的繁琐.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3和稀盐酸 | B. | Al2O3和水 | C. | Al2(SO4)3和NaOH | D. | AlCl3和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; .
.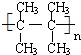 在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.
在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 02是还原剂 | B. | FeS2是氧化剂 | ||
| C. | 02失去电子 | D. | FeS2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
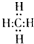 ,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.
,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1NA | |
| D. | 密闭容器中2mol NO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
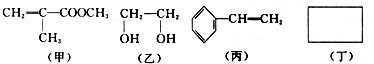
 (-R为烃基)
(-R为烃基)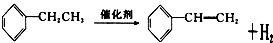
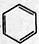 +CH3CH2Cl
+CH3CH2Cl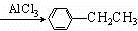 +HCl.
+HCl.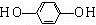 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com