
分析 (1)根据仪器的作用选取仪器;碎瓷片有防暴沸作用;
(2)氯气具有强氧化性,能氧化溴离子生成溴单质,自身被还原为氯离子;
(3)溴、二氧化硫和水发生氧化还原反应生成硫酸和氢溴酸,该反应中S元素化合价由+4价变为+6价,Br元素化合价由0价变为-1价,得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系式计算;
(4)萃取剂的选取标准是:和原溶剂不互溶,和溶质不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度.
解答 解:(1)还需要盛放海水的蒸馏烧瓶;碎瓷片有防暴沸作用,防止液体剧烈沸腾而产生安全事故,故答案为:蒸馏烧瓶;防暴沸;
(2)氯气具有强氧化性,能氧化溴离子生成溴单质,自身被还原为氯离子,离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(3)溴、二氧化硫和水发生氧化还原反应生成硫酸和氢溴酸,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,该反应中S元素化合价由+4价变为+6价,Br元素化合价由0价变为-1价,得电子化合价降低的反应物是氧化剂,所以Br2是氧化剂,1mol氧化剂在反应中得到2mol电子,
故答案为:SO2+Br2+2H2O=2HBr+H2SO4;Br2;2;
(4)萃取剂的选取标准是:和原溶剂不互溶,和溶质不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,盐酸、酒精和乙酸都易溶于水,所以不能作萃取剂,苯符合条件,可以作萃取剂,故选D.
故答案为:D.
点评 本题考查海水资源综合利用,涉及氧化还原反应、萃取剂的选取标准、仪器的选取等知识点,明确物质的性质、萃取剂特点等知识点即可解答,题目难度中等,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | NaCl 的电子式 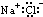 | ||
| C. | Cl-离子的结构示意图: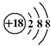 | D. | CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
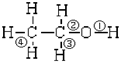
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和④断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

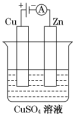
| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com