
我国大力发展水力发电站建设,如葛洲坝,年发电量相当于每年燃烧3000万吨煤的火力发电站了出的电量,水力发电和火力发电相比,下列说法中正确的是( )
①减少CO2的排放有利于减轻温室效应②减少SO2的排放有利于减少降酸雨③减少废渣排放有利减少对土壤、水体污染④减轻白色污染
A.①②③④ B.①②③ C.①② D.①
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:实验题
某研究性学习小组为合成1 一丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2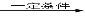 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH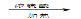 CO+H2O,并设计出原料气的制备装置(如图)。
CO+H2O,并设计出原料气的制备装置(如图)。
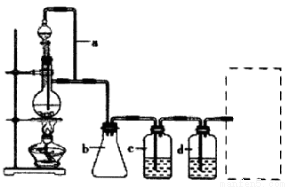
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式:_______________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)
① 饱和Na2SO3溶液② 酸性KMnO4溶液③ 石灰水④ 无水CuSO4 ⑤ 品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_____________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:① RCHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为_________,操作1为__________,操作2为__________,操作3为___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上入学考试化学试卷(解析版) 题型:选择题
下列说法中错误的是
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:选择题
在天平两端的烧杯中,分别盛有足量等质量、等质量分数的稀硫酸,天平平衡后,往天平两端的烧杯中,分别加入等质量的镁和铜、铝合金,恰好完全反应,且天平仍保持平衡,则铜、铝合金中铜和铝的质量比为( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:选择题
有甲、乙、丙、丁四种溶液,乙与丙混合产生的沉淀不溶于甲,乙与丁混合产生的沉淀可溶于甲。则该溶液组是( )

查看答案和解析>>
科目:高中化学 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:填空题
【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上9月月考化学试卷(解析版) 题型:选择题
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-< Fe2+ < H2O2<I-<SO2 。下列反应不能发生的是
A.2Fe3++SO2+2H2O=2Fe2++SO42—+4H+
B.2Fe3++2I—==2Fe2++I2
C.I2+SO2+2H2O==H2SO4+2HI
D.H2O2+H2SO4==SO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:填空题
Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化 学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
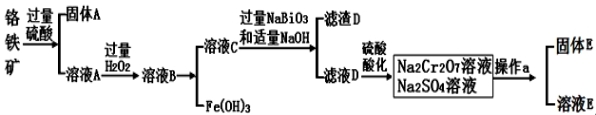
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
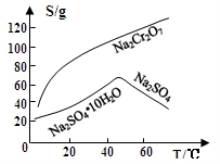
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com