
某同学用下列装置制备并检验Cl2的性质.

(1)Ⅰ图圆底烧瓶中反应的化学方程式为 .
(2)Ⅱ图中褪色的是b (填“a”或“b”),Ⅱ图烧杯中发生反应的化学方程式是 .
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,你认为铁丝也能点燃的理由是 (填选项字母).
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高 C.Fe的密度比Cu小 D.Fe的金属性比Cu强
(4)实验室也可用氯酸钾与盐酸反应制备氯气.当使用K37ClO3与H35Cl制备时,所得氯气的平均相对分子质量是 (保留一位小数)
(5)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生
产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,请写出该方法制备ClO2的化学反应方程式 .
考点: 氯气的实验室制法;氯气的化学性质.
分析: (1)二氧化锰与浓盐酸反应生成氯气;
(2)干燥的氯气没有漂白性,次氯酸具有漂白性;氯气与NaOH反应生成NaCl和NaClO、水;
(3)Fe的金属性比Cu强,能与氯气反应生成氯化铁;
(4)K37ClO3+6H35Cl=K35Cl+35Cl37Cl↑+35Cl2↑+3H2O,据此分析;
(5)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2.
解答: 解:(1)二氧化锰与浓盐酸反应生成氯气,其反应的方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)干燥的氯气没有漂白性,氯气与水发育生成次氯酸,次氯酸具有漂白性,所以b褪色;氯气与NaOH反应生成NaCl和NaClO、水,其反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:b;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,因为Fe的金属性比Cu强,能与氯气反应生成氯化铁;
故答案为:D;
(4)K37ClO3+6H35Cl=K35Cl+35Cl37Cl↑+235Cl2↑+3H2O,反应产物中有一个35Cl37Cl和两个35Cl2,则氯气的平均相对分子质量是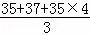 =70.7;
=70.7;
故答案为:70.7;
(5)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2,其反应方程式为:2NaClO3+Na2SO3+H2SO4═2ClO2↑+2NaSO4+H2O;
故答案为:2NaClO3+Na2SO3+H2SO4═2ClO2↑+2NaSO4+H2O.
点评: 本题考查了气体的实验室制法、反应原理、物质的性质,题目难度中等,侧重于考查学生的实验能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:
25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L 盐酸,应加 mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积 (填“多”、“少”、“一样”)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有关水溶液的pH说法正确的是 ( )。
A.在pH=12的溶液中,水电离出的c(OH-)一定等于10-2 mol·L-1
B.将pH=2和pH=12的酸碱溶液等体积混合后,溶液的pH一定等于7
C.若强酸、强碱中和后pH=7,则中和之前酸、碱的pH之和为14
D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是()
A. 将Na2CO3固体加入新制的氯水中,有无色气泡(H+)
B. 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2)
C. 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl﹣)
D. 新制氯水使红色布条褪色(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是()
A.  (A﹣N+m)mol B.
(A﹣N+m)mol B. 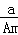 (A﹣N)mol C.
(A﹣N)mol C.  (A﹣N)mol D.
(A﹣N)mol D. 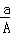 (A﹣N+m)mol
(A﹣N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的化学方程式或离子方程式正确的是
|
B.双氧水催化分解:H2O2 ===== H2 ↑+ O2↑
C.草酸与酸性高锰酸钾反应的离子方程式: H2C2O4+6H++MnO4-=Mn2-+4H2O+2CO2↑
D.FeCl3溶液中加入几滴KSCN : FeCl3+ 3KSCN  Fe(SCN)3↓+3KCl
Fe(SCN)3↓+3KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
(1) 实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是______。
(2) 为尽量减小误差,下列操作的正确顺序是______(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹
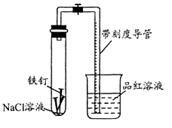 ③将导管口浸入品红溶液
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3) 检查装置气密性的方法:_______________________________。
(4)实验中试管内发生的反应为:____________________________。
用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,
②__________________________________________。
(5) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
假设一:电解质溶液的PH 假设二: NaCl溶液的浓度 假设三:铁钉的表面积
(6)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是______
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:____________;
第二步: ______,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是( )
|
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 氯乙烷 | D. | 淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
②2CH3CHO+O2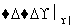 2CH3COOH。
2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图CB33所示。
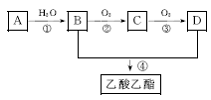
图CB33
回答下列问题:
(1)写出A的电子式:____________________。
(2)B、D分子中的官能团名称分别是__________、__________。
(3)写出下列反应的反应类型:①___________反应,②___________反应,④________反应。
(4)写出下列反应的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com