
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
I��2015�����C919���Ϳͻ���ʽ���ߣ���־���ҹ���Ϊ�������������������������ƴ��ͷɻ��Ĺ���֮һ����־���ҹ����չ�ҵ�������µķ�չ�Ρ�
��1���ɻ������ͨ������þ�����Ͻ���ϣ����ļ۵����Ų�ͼΪ ����һ�����ܣ�þ ������ڡ���С�ڡ�������
��2���ִ��ɻ�Ϊ�˼�����������������dz�ѹ������ͨ�����ø��ϲ���--������ά��ǿ���ϣ���ɷ�֮һΪ������֬��������E51�ͻ�����֬�в��ֽṹ����ͼ��ʾ��
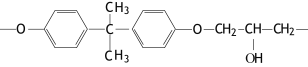
����̼ԭ�ӵ��ӻ���ʽΪ ��������Ϊ ��
II�����ͷɻ��ķ���������Ϊ���չ�ҵ�ʹ��ϵġ���ʯ�������������ͨ������̼�������ؼ���λ�IJ��ϡ�
��3����Ԫ��λ�����ڱ��ĵ������ڵ�VIB�壬��д������Χ�����Ų�ʽ ��
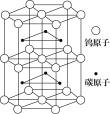
��4����ͼΪ̼���پ����һ���ֽṹ�� ̼ԭ��Ƕ������ٵľ���ļ�϶�������ƻ�ԭ�н����ľ����γ���϶+�����壬Ҳ��Ϊ��϶������ڴ˽ṹ�У�������ԭ���� ����1����ԭ����Χ������ԭ�������̼ԭ���� �� �����н���Ԫ�صĶѻ���ʽ��̼���پ�����̼ԭ�Ӻ���ԭ������λ�����Ƶ��� ��
A. Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
��5������ò��־�������ΪVcm3��̼���ٵ�Ħ������ΪM g/mol���ܶ�Ϊb g/cm3,���ӵ�����NA���������ݿ��Ա�ʾΪ ��
���𰸡���1�� ��1�֣������ڣ�1�֣�
��1�֣������ڣ�1�֣�
��2��sp2��1�֣�sp3��1�֣�,2��1
��3��5d46s2����5d56s1��2�֣�
��4��6��1�֣���6��1�֣���C��2�֣���5��![]() ��3�֣�
��3�֣�
��������
�����������1������13��Ԫ�أ��������3�����ӣ����ݺ�������Ų����ɣ����ļ۵����Ų�ͼΪ ��þ��������ͬһ����Ԫ�أ�þԭ�ӵ����������Ų�Ϊ2s2������ȫ����״̬����ԱȽ��ȶ�����һ�����ܱ�ͬ��������Ԫ�صĵ�һ�����ܶ������Ե�һ�����ܣ�þ��������
��þ��������ͬһ����Ԫ�أ�þԭ�ӵ����������Ų�Ϊ2s2������ȫ����״̬����ԱȽ��ȶ�����һ�����ܱ�ͬ��������Ԫ�صĵ�һ�����ܶ������Ե�һ�����ܣ�þ��������
��2�����ݻ�����֬�Ľṹ��ʽ��֪��������̼Ԫ�ز����γ������������γɱ��������̼ԭ�ӵ��ӻ����������sp2��sp3����Ӧ������Ϊ12��6��2��1��
��3����Ԫ��λ�����ڱ��ĵ������ڵ�VIB�壬����Χ�����Ų�ʽΪ5d56s1��
��4��̼���پ���ṹ�����ڽ���Zn��Ti��Mg���������ܶѻ����������ÿ����̼���ٽ������еģ�������λ������Ϊ6�������ڴ˽ṹ�У�������ԭ����6����1����ԭ����Χ������ԭ�������̼ԭ����6�������н���Ԫ�صĶѻ���ʽ��̼���پ�����̼ԭ�Ӻ���ԭ������λ�����Ƶ���C��
��5�����þ�̯�����㣬�þ�������ԭ�Ӹ�����2��6��1/3��1/2+2��1/2+1+6��1/3��6����������̼ԭ�Ӹ�Ϊ6�����Ѿ�֪����������������ܶ���m��V��b��6M��(NA��V),����NA��![]() ��
��
����ʦ���硿�������Ų�ͼ����һ�����ܡ��ӻ����͵��жϣ������ļ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У���ʹ�õ�װ��(�г�װ����)���Լ��Ͳ�����������ȷ����
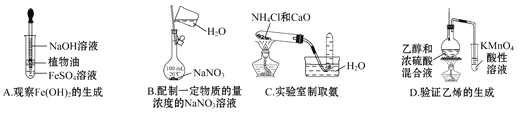
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽ��ͼ�����й��ڷ�֦���������ȷ����( ��

A��1mol��֦��������3molNaOH�����кͷ�Ӧ
B�������Ҵ������ᷴӦ���ҷ�Ӧ������ͬ
C�������к���2 �ֹ�����
D����ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ��ṩ�����ݣ������ж���ȷ����
���ữѧʽ | CH3COOH | HClO | H2CO3 |
����ƽ�ⳣ�� | 1.8��10-6 | 3.0��10-8 | Ka1=4.3��10-7 Ka2=5.6��l0-11 |
A. �����ʵ�����Na2CO3��CH3COOH������Һ��ϣ�һ���У�c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. �����£���֪��H2A��������ƽ�⣺H2A![]() H++HA-��HA-
H++HA-��HA-![]() H++A2-(Ka1=5.9��10-2,Ka2=6.4��10-6)����NaHA��Һ��ˮ�ĵ���̶�һ�����ڴ�ˮ��ˮ�ĵ���̶�
H++A2-(Ka1=5.9��10-2,Ka2=6.4��10-6)����NaHA��Һ��ˮ�ĵ���̶�һ�����ڴ�ˮ��ˮ�ĵ���̶�
C. ��ͬŨ�ȵ�CH3COONa��NaClO�����Һ�и�����Ũ�ȴ�С��ϵ�ǣ�C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D. �����£���0.1mol/LCH3COOH��Һ�еμ�0.1mol/LNaOH����Һ������Ӧ����c(CH3COOH����c��CH3COO-��=5:9ʱ����ʱ��ҺpH=5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��������Һ�У�����������������
A��CaCl2 B��CH3COONa C��NH3 D��K2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϩ��һ�ֳ��õ����ϡ����и���ԭ���ʺ��ںϳɾ�����ϩ����
A.�Ҵ����Ȼ���B.���顢�Ȼ���C.��ϩ���Ȼ���D.��Ȳ���Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֮���ת����ϵ����ͼ������������ʡ����C��D����X��Y��Z������Ԫ����ɵĻ�������X��Y��Z��ԭ���������������������ڱ���X��ԭ�Ӱ뾶��С��Y��Zԭ������������֮��Ϊ10��DΪ��ɫ�ǿ�ȼ��������GΪ����ɫ����������J��MΪ������I��Ư����������Ӧ������������ӡˢ��·����

��ش�����������
(1)GԪ�������ڱ��е�λ��______________________��C�ĵ���ʽ______________��
(2)�Ƚ�Y��Z��ԭ�Ӱ뾶��С��___________________(��дԪ�ط���)��
(3)д��E����ȩ��Ӧ�Ļ�ѧ��Ӧ����ʽ(�л����ýṹ��ʽ��ʾ)��___________________________��
��Ӧ������_____��
(4)д��ʵ�����Ʊ�G�����ӷ�Ӧ����ʽ��_______________________��
(5)����D��NaOH��Һ��Ӧ������������P��Q����P��Na����������Ϊ43%��������Ϊ____________��
(6)ʵ�����м���L��Һ�е������ӳ�ѡ��__________(�ѧʽ)��Һ��������______________��
(7)A�а���X��Y��ZԪ����A�Ļ�ѧʽΪ_____________��
(8)�о�����������D��һ�������¿ɱ���ԭΪ��Ө���ľ���N����ṹ��ԭ�ӵ�����Ϊ������������д��N����һ��ͬ�������������_______________________________________��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

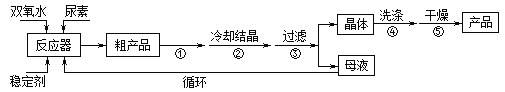
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʡ���;��˵������ȷ����
A. �辧�������õİ뵼�壬������������ά
B. ��ѹ�ƵƷ����Ļƹ�������ǿ�������ڵ�·�㳡����
C. ��ʯ������ˮ��Ӧ�������ڳ�ȥCO2������������ˮ����
D. ̼���ƾ��м��ԣ���������θ���кͼ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com