
许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A.氯、溴、碘B.钠、镁、铝C.食盐、淡水D.烧碱、氢气
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高一化学试卷(解析版) 题型:选择题
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A.v(H2)=0.03mol/(L·min) B.v(N2)=0.005mol/(L·min)
C.v(NH3)=0.17mol/(L·min) D.v(NH3)=0.02mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:简答题
(6分) 0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(提示:同一个C原子连两个羟基是不稳定结构)通过计算解决以下两个问题,要有必要计算过程:
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol C10H22含共价键数目32NA
B.常温常压下,8gCH4含有电子数目5NA
C.1L 0.1mol?L-1的醋酸溶液中含有CH3COO-的数目0.1NA
D.78g苯含有C=C双键的数目为3NA
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合“绿色化学”原子经济性要求的是
A.乙烯发生加聚反应制得聚乙烯高分子材料 B.用甲烷与氯气制备一氯甲烷
C.用苯和液溴为原料制取溴苯 D.用石灰石和稀盐酸反应制得二氧化碳
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:实验题
(共15分) 某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
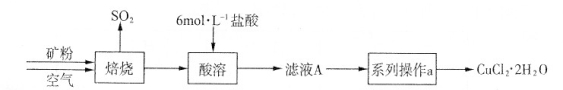
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有_______________ 、 _______________ 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是_______ (填下列各项中序号)。

②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- 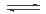 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是____ (填下列各项中序号)。 a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。

①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为下列四阶段:

第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 _______________ 。
②300~400oC范围内,固体质量明显增加的原因是_______________,上图所示过程中,CuSO4固体能稳定存在的阶段是__________(填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。

a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作 __________ 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为_______________ 溶液。
c.若原CuS矿样的质量为l0.0 g(含加热不反应的杂质),在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.4 g,则原矿样中CuS的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:选择题
欲检验CO2气体中是否含有SO2、HC1,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
下列说法正确的是
A.沉淀a为AgC1 B.沉淀b为BaCO3
C.气体中含有SO2 D.气体中没有HC1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:填空题
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)? 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
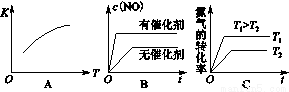
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于化学反应的速率和限度的说法不正确的是( )
A.任何可逆反应都有一定的限度
B.影响化学反应速率的条件有温度、催化剂、浓度等
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.决定反应速率的主要因素是反应物的性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com