
| A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子 |
| B.构成单质的分子中一定含有共价键 |
| C.溶液和胶体的本质区别是有无丁达尔效应 |
| D.化学变化不产生新元素,产生新元素的变化不是化学变化 |
科目:高中化学 来源:不详 题型:单选题
| A.工业上电解YW饱和溶液冶炼金属Y |
| B.气态氢化物的稳定性:W > X |
| C.简单离子半径的大小顺序:r(Y+)>r(X—) |
| D.Y、W的最高价氧化物的水化物均能溶解金属Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 类比对象 | 结论 |
| A | Cl2+H2O HCl+HClO HCl+HClO | I2+H2O HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 X+2WZ
X+2WZ| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
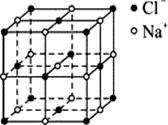
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属与非金属的分界线附近区域 | B.过渡元素区域 |
| C.氟、氯、硫、磷等元素附近区域 | D.元素周期表左下部分主族元素区域 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 最外层电子数是次外层的3倍 |
| Z | 短周期中,其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com