
 .请根据如图回答:
.请根据如图回答:
 .
. ;④
;④ .
. +C2H5OH
+C2H5OH分析 A发生水解反应C、D、E,C氧化得D,根据题中信息可知,C的结构简式为CH3CHO,D为CH3COONa,E为NaBr,B的最大质荷比为208,所以B的相对分子质量为208,红外光谱显示B分子中含有苯环结构和两个酯基,核磁共振氢谱中有五个吸收峰,其峰值比为2:2:2:3:3,其中苯环上的一氯代物只有两种,B碱性水解得D和C,则B为 ,B碱性水解得F为
,B碱性水解得F为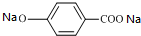 ,G为CH3CH2OH,以CH3CH2OH为原料合成乙酰乙酸乙酯(CH3COCH2COOC2H5),可以先用乙醇氧化得乙酸,乙醇与乙醇酯化得乙酸乙酯,在乙酸乙酯钠的作用下发生题中信息中的反应得乙酰乙酸乙酯,据此答题;
,G为CH3CH2OH,以CH3CH2OH为原料合成乙酰乙酸乙酯(CH3COCH2COOC2H5),可以先用乙醇氧化得乙酸,乙醇与乙醇酯化得乙酸乙酯,在乙酸乙酯钠的作用下发生题中信息中的反应得乙酰乙酸乙酯,据此答题;
解答 解:A发生水解反应C、D、E,C氧化得D,根据题中信息可知,C的结构简式为CH3CHO,D为CH3COONa,E为NaBr,B的最大质荷比为208,所以B的相对分子质量为208,红外光谱显示B分子中含有苯环结构和两个酯基,核磁共振氢谱中有五个吸收峰,其峰值比为2:2:2:3:3,其中苯环上的一氯代物只有两种,B碱性水解得D和C,则B为 ,B碱性水解得F为
,B碱性水解得F为 ,G为CH3CH2OH,
,G为CH3CH2OH,
(1)根据A的结构简式可知,A中所含官能团的名称为酯基、溴原子,
故答案为:酯基、溴原子;
(2)根据上面的分析可知,B的结构简式为 ,
,
故答案为: ;
;
(3)反应①的方程式为 ,反应 ④的方程式为
,反应 ④的方程式为 ,
,
故答案为: ;
; ;
;
(4)B为 ,根据条件①属于芳香族化合物,说明有苯环;②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应,说明有酯基和醛基,则符合条件的B的同分异构体为在苯环的间位连有两个HCOO-和一个-C3H7,有三种排列方法,且-C3H7有2种结构,所以共有6种结构,也可以是在苯环的间位连有两个HCOOCH2-和一个-CH3,有三种排列方法,所以共有9种,
,根据条件①属于芳香族化合物,说明有苯环;②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应,说明有酯基和醛基,则符合条件的B的同分异构体为在苯环的间位连有两个HCOO-和一个-C3H7,有三种排列方法,且-C3H7有2种结构,所以共有6种结构,也可以是在苯环的间位连有两个HCOOCH2-和一个-CH3,有三种排列方法,所以共有9种,
故答案为:9;
(5)以CH3CH2OH为原料合成乙酰乙酸乙酯(CH3COCH2COOC2H5),可以先用乙醇氧化得乙酸,乙醇与乙醇酯化得乙酸乙酯,在乙酸乙酯钠的作用下发生题中信息中的反应得乙酰乙酸乙酯,合成路线为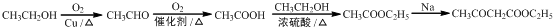 ,
,
故答案为: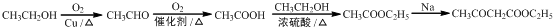 .
.
点评 本题考查有机物的推断,难度中等,注意计算确定B的分子式,根据有机物的官能团的变化为突破口进行推断,需要学生熟练掌握官能团的结构与性质.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NH4+、Cl-、AlO2- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、HCO3-、Cl-、SO4 2- | D. | Fe3+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学做如图实验,以检验反应中的能量变化.
某同学做如图实验,以检验反应中的能量变化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性F->Cl->S2- | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 乙烯比例模型  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com