
| A、A、C、D的物质的量浓度相等 |
| B、混合气体的密度不再改变 |
| C、气体的总物质的量不再改变 |
| D、v(B)=2v(C) |
| 总质量 |
| 体积 |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、0.6mol/L |
| B、0.06mol/(L?s) |
| C、0.03mol/L |
| D、0.03mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
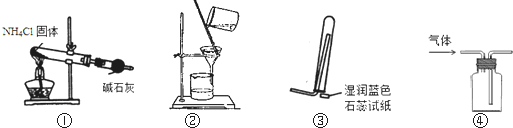
| A、用①装置制取干燥的氨气 |
| B、用②装置除去淀粉溶液中的NaCl |
| C、③装置可用于氨气的收集、检验 |
| D、④装置可用排空气法收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钡和硫酸钡均可用于钡餐透视 |
| B、为防止食物变质,可加入适量的食品添加剂 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙两容器体积相等 |
| B、平衡时甲、乙两容器中c(H2)相等 |
| C、平衡时甲、乙两容器中反应速率v(H2)相等 |
| D、平衡时甲、乙两容器中气体总的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
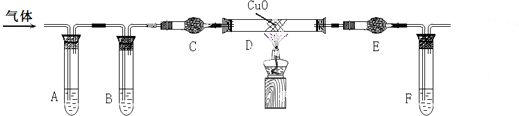
查看答案和解析>>
科目:高中化学 来源: 题型:
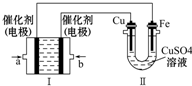 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com