
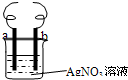
 用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )
用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )| A、构成原电池时b极反应为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少 |
| D、构成的原电池或电解池工作后都会产生大量气体 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| N | F | |||||
| Mg | Al | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铝片加入少量烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B、利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| D、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,CO |
| B、2,CO2 |
| C、2,H2 |
| D、1,H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将氯化铝溶液蒸干灼烧并熔融后用铂电极行电解 | 阳极产出使带火星木条复燃的气体 | 阳极产生的是氧气 |
| B | 在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热 | 无砖红色沉淀生成 | 淀粉未水解 |
| C | 在浓硫酸中加入铜片,加热 | 铜片逐渐溶解并产生气体 | 有H2产生 |
| D | 在漂白粉(主要成分为Ca(ClO)2和CaCl2)中滴入70%的硫酸 | 产生黄绿色的气体能使湿润的淀粉碘化钾试纸变蓝 | 有Cl2产生 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com