
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3溶液 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
A
【解析】
试题解析:Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,为了减缓反应速度,且不影响生成氢气的总量,则可减小氢离子的浓度,但不改变氢离子的物质的量。加入NaOH固体,氢离子的物质的量及浓度均减小,故①错误;加入H2O,减小氢离子的浓度,但不改变氢离子的物质的量,故②正确;NH4Cl固体,不影响氢离子浓度,不改变反应速率,故③错误;④加入CH3COONa固体与盐酸反应生成弱酸,减小氢离子的浓度,但不改变氢离子的物质的量,故④正确;NaNO3溶液,酸性条件下,硝酸根具有强氧化性,与铁反应不能产生氢气,减少了氢气的生成量,故⑤错误;加入KCl溶液,相当于加水稀释,减小氢离子的浓度,但不改变氢离子的物质的量,故⑥正确;故应选②④⑥。
考点:化学反应速率的因素


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为
A.(b-a) /V mol·L-1 B.(2b-a)/V mol·L-1
C.2(b-a)/V mol·L-1 D.2(2b-a)/V mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
反应PCl5(g) PCl 3(g)+Cl2(g) ①;
PCl 3(g)+Cl2(g) ①;
2HI(g) H2(g)+I2(g) ②;
H2(g)+I2(g) ②;
2NO2(g) N2O4(g) ③;
N2O4(g) ③;
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
A.均不变 B.均增大
C.①增大,②不变,③减少 D.①减少,②不变,③增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
已知:SO2(g)+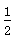 O2(g)
O2(g) 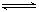 SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
A.5 min内用O2表示的反应速率为0.12 mol/(L·min)
B.该反应的平衡常数数值为7.5
C.SO2的平衡转化率为60%
D.加入催化剂,可使ΔH变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列有关电解质的说法中正确的是
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:填空题
(14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
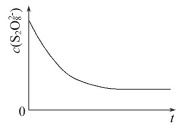
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s) ΔH
2LiI(s) ΔH
已知: ①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s) ΔH2
2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是
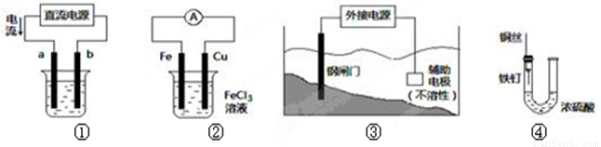
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
已知可逆反应X(g)+2Y(g) Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是

A.a点正反应速率大于逆反应速率
B.增大X的浓度,X的转化率增大
C.容器中压强恒定时,不能说明反应已达平衡状态
D.保持温度和密闭容器的压强不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com