
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:
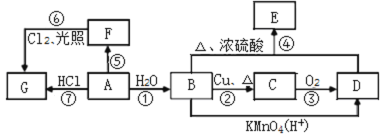
(1)写出A中官能团的名称:A________,B中官能团的电子式B________。
(2)在F的同系物中最简单的有机物的空间构型为________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________。
(4)写出下列编号对应反应的化学方程式。
④ _____________________________;⑦ _____________________________。
【答案】碳碳双键 ![]() 正四面体 C(CH3)4 CH3CH2OH+CH3COOH
正四面体 C(CH3)4 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O CH2=CH2+HCl
CH3COOCH2CH3+H2O CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】
由题意,A 常用来衡量一个国家石油化工发展水平的标志性物质,则A为CH2=CH2;一定条件下,CH2=CH2与水发生加成反应生成CH3CH2OH,则B为CH3CH2OH;在铜做催化剂作用下,CH3CH2OH发生催化氧化生成CH3CHO,则C为CH3CHO;CH3CHO进一步发生氧化反应生成CH3COOH,则D为CH3COOH;在浓硫酸作用下,乙酸与乙醇共热发生酯化反应生成CH3COOCH2CH3,则E为CH3COOCH2CH3;一定条件下,乙烯与氢气发生加成反应生成C2H6,则F为C2H6;一定条件下,乙烯与HCl发生加成反应生成CH3CH2Cl,则G为CH3CH2Cl,乙烷与氯气在光照条件下发生取代反应也能生成CH3CH2Cl。
(1)A的结构简式为CH2=CH2,官能团为碳碳双键;B的结构简式为CH3CH2OH,官能团为羟基,羟基的电子式为![]() ,故答案为:碳碳双键;
,故答案为:碳碳双键;![]() ;
;
(2)F为C2H6,属于烷烃,最简单的烷烃为甲烷,甲烷的空间构型为正四面体,故答案为:正四面体;
(3)烷烃含5个碳原子的是戊烷,戊烷有3种同分异构体,结构简式为CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4,CH3CH2CH2CH2CH3的一氯代物有3种,CH3CH2CH(CH3)2的一氯代物有4种,C(CH3)4的一氯代物有1种,故答案为:C(CH3)4;
(4)反应④为在浓硫酸作用下,乙酸与乙醇共热发生酯化反应生成CH3COOCH2CH3,反应的化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;反应⑦为一定条件下,乙烯与HCl发生加成反应生成CH3CH2Cl,反应的化学方程式为CH2=CH2+HCl
CH3COOCH2CH3+H2O;反应⑦为一定条件下,乙烯与HCl发生加成反应生成CH3CH2Cl,反应的化学方程式为CH2=CH2+HCl![]() CH3CH2Cl,故答案为:CH3CH2OH+CH3COOH
CH3CH2Cl,故答案为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;CH2=CH2+HCl
CH3COOCH2CH3+H2O;CH2=CH2+HCl![]() CH3CH2Cl。
CH3CH2Cl。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子的易溶盐。以卤块为原料可制得轻质氧化镁,工艺流程如图:
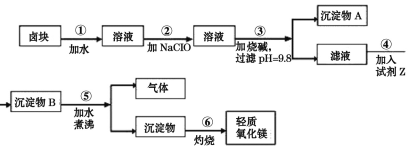
已知:(1)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(2)原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(3)生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列问题:
(1)某课外兴趣小组设计实验证明卤块中含有Fe3+为:取少许样品加水溶解,____,则说明卤块中含Fe3+。
(2)工业上冶炼镁常用的方法的化学方程式为____。
(3)步骤②加入NaClO而不用H2O2的原因是____,步骤②反应后产生少量红褐色沉淀,该反应中氧化剂与还原剂的比例为____。
(4)沉淀A的主要成分为____;步骤④加入的物质为____。
(5)步骤⑤发生的反应的化学方程式为____。
(6)步骤⑥如在实验室进行,应选用在____(填仪器名称)中灼烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)重结晶仅适用于固体有机物的分离和提纯。(_____)
(2)可以用酒精作萃取剂萃取溴水中的溴。(_____)
(3)萃取法只适用于从液体中萃取物质。(_____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
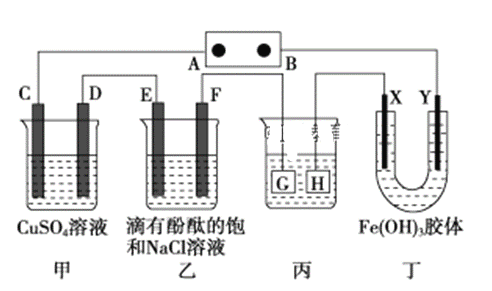
(1)B极是电源的________极,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带___电荷(填“正”或“负”,在电场作用下向____极移动(填“X”或“Y”)。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_________________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A.HI和HClOB.HCl和HIOC.HClO3和HIOD.HClO和HIO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ:______________________________________。
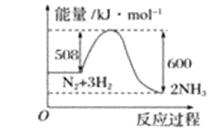
(2)根据下图写出热化学方程式__________________________________________。
(3)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式,并判断其反应类型(加成、取代、氧化)
①甲烷与氯气反应_______________________________,属于________反应
②乙烯通入溴水:_________________________________,属于________反应
③乙醇与金属钠反应:__________________________________,属于________反应
④由苯制取硝基苯:_______________________________,属于________反应;
⑤灼热的铜丝多次反复地插入乙醇中:___________________,属于_______反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种元素在周期表中的位置如下图所示,已知A、B、C原子序数之和为37。下列关于A、B、C三种元素的说法正确的是
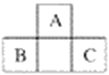
A. 元素B和C位于第四周期 B. 元素A的原子序数为7
C. 元素B最外层有5个电子 D. 元素C位于第三周期ⅤA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com