
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
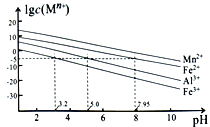
③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为________。
(2)“氧化”时,发生反应的离子方程式为_________________________。若省略“氧化”步骤,造成的后果是_________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“系列操作”指___________、过滤、洗涤、干燥。
【答案】产生硫化氢等气体,污染环境 MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O Fe2+与Mn2+沉淀区有重叠,造成Mn2+损失 Fe(OH)3、Al(OH)3 8×10-3 mol·L-1 蒸发浓缩、冷却结晶
【解析】
高硫锰矿中含硫量较高,有一部分硫以-2价的S2-形式存在,所以加硫酸酸浸时会生成硫化氢气体;依据题给的焙烧后的烧渣成分,一一分析各步的分离与除杂。将离子浓度10-5mol·L-1代入Ksp的表达式,计算出F-的最小浓度。
(1)传统工艺采用硫酸浸出,此时MnS或FeS发生复分解反应生成H2S气体,污染环境,造成浪费;
(2)“氧化”时加入的是二氧化锰是氧化剂,还原剂是Fe2+,所以发生反应的离子方程式为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;将Fe2+氧化为Fe3+,在Mn2+尚未开始沉淀时,Fe3+已沉淀完全,若不氧化,则Fe2+与Mn2+沉淀的pH范围有重叠,沉淀法除Fe2+时会造成Mn2+损失;
(3)加入碳酸钙进行中和除杂时,生成的沉淀为Fe(OH)3、Al(OH)3;
(4)根据氟化钙和氟化镁的Ksp可分别计算出钙镁离子完全沉淀时氟离子的浓度,由Ksp(MgF2)=c(Ca2+)c(F-)2,求得钙离子完全沉淀时c(F-)=6×10-4mol·L-1,同理求得镁离子完全沉淀时c(F-)=8×10-3mol·L-1,当氟离子的浓度能使钙离子完全沉淀时,镁离子并没有完全沉淀,所以若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于能使镁离子完全沉淀的浓度,即不低于8×10-3mol·L-1,注意不要忘写单位;
(5)“系列操作”实现了从溶液中获得MnSO4·4H2O,因为后有“过滤、洗涤、干燥”,所以前面必有结晶。由于绝大多数固体的溶解度随温度降低而降低,所以选择降温(冷却)结晶。在结晶前应先蒸发浓缩,使溶液在较高温度下形成饱和溶液或过饱和溶液。所以本题的答案为“蒸发浓缩、冷却结晶”。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】以溴乙烷为原料制备乙二醇,下列方案中最合理的是
A. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
C. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2BrCH2OH
CH2BrCH2OH![]() 乙二醇
乙二醇
D. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
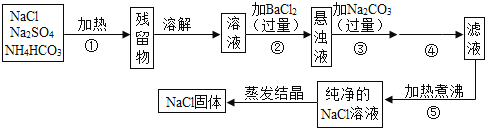
试回答下列问题:
(1)操作①的目的是_______。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______。
(3)写出操作③有关的化学反应方程式_______。操作④的名称是_______。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1_______m2(填“>”、“<”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
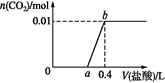
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
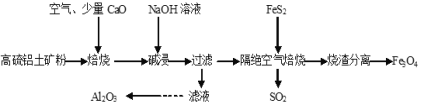
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫________;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:CO2和CO的体积之比是________。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度分别是________
(6)现有以下物质:①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧浓H2SO4 ⑨KOH固体;以上物质中属于电解质的是________
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。

已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射一段时间后
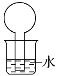
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 烧瓶内的液体可能会分层
D. 向水中加入石蕊试液后无变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com