
分析 根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算.
解答 解:由n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$可知,N2、CO2、SO2三种气体的物质的量比为1:1:1时.它们的分子个数比为1:1:1,同温同压下Vm相等,则体积之比为1:1:1,
质量之别等于摩尔质量之比,为28:44:64=7:11:16,
故答案为:1:1:1;7:11:16;1:1:1.
点评 题考查物质的量的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式,难度不大.


科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:实验题
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O  Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
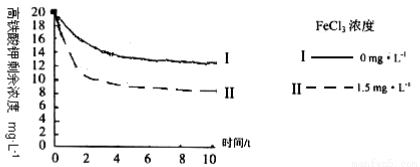
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。
(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 实验序号 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | pH | … |
| 1 | 250 | m | T1 | X | … |
| 2 | 250 | m | T2 | Y | … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | T/K | A的初始浓度/mol•L-1 | B的初始浓度/mol•L-1 | 催化剂的比表面积/m2•g-1 |
| Ⅰ | 200 | 0.40 | 0.60 | 82 |
| Ⅱ | T | 0.40 | 0.60 | 124 |
| Ⅲ | 220 | c1 | c2 | S |
| A. | T=200 | B. | S=100 | C. | c1=0.40 | D. | c2=0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 各物理及化学性质均相同 | |
| B. | 主要成份都是烷烃,环烷烃和芳香烃 | |
| C. | 裂化汽油中含有一些不饱和链烃,而直馏汽油中不含 | |
| D. | 可以用溴水或酸性高锰酸钾溶液来区别它们 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若该反应在较低温度下能自发进行,则△H<0 | |
| B. | 在该温度下上述反应的平衡常数K=4 | |
| C. | 达到平衡时生成了0.125amol CaS | |
| D. | 向上述体系中加入石灰石,能提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学试卷(解析版) 题型:选择题
可通过实验来验证淀粉水解可生成还原性糖,其实验包括下列一些操作过程,这些操作过程正确的顺序是
①取少量淀粉加水制成溶液②加热煮沸③加入碱液中和并呈碱性
④加入新制Cu(OH)2悬浊液⑤加入几滴稀硫酸⑥再加热
A.①②⑤⑥④③ B.①⑤②④⑥③
C.①⑤②③④⑥ D.①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:填空题
在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中
CuSO4+SO2↑+2H2O反应中
(1)__________元素被氧化,__________是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)若有2.4mol的H2SO4参与反应,则被还原的H2SO4为__________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com