
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |
分析 A.过滤时应防止液体飞溅;
B.滴加试剂时应防止污染滴管;
C.滴定接近终点时,滴定管的尖嘴可接触锥形瓶内壁,可使滴定管流出的液体充分反应;
D.向容量瓶转移液体时,应防止流出容量瓶外.
解答 解:A.过滤时为防止液体飞溅,漏斗的尖端应接触烧杯内壁,使滤液沿烧杯内壁缓缓流下,故A正确;
B.滴加试剂时应防止污染滴管,滴管不能接触试管内壁,故B错误;
C.滴定接近终点时,滴定管的尖嘴可接触锥形瓶内壁,可使滴定管流出的液体充分反应,故C正确;
D.向容量瓶转移液体时,为防止流出容量瓶外,可使导流用玻璃棒可以接触容量瓶内壁,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
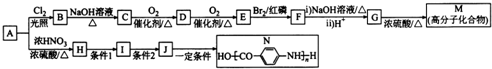
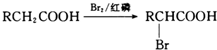
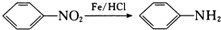 (-NH2易被氧化)
(-NH2易被氧化) 、
、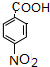 .
.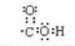 .H的化学名称为对硝基甲苯.
.H的化学名称为对硝基甲苯. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$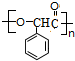 +nH2O.
+nH2O.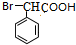 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$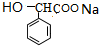 +NaBr+H2O.
+NaBr+H2O.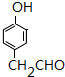 .
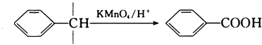
. 的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$
的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$ (无机试剂任选).
(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
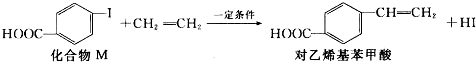
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铝丝放入浓硫酸中 | 无明显现象 | 铝丝发生了钝化 |
| B | 将SO2通入过量的Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性:H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加足量的MgSO4溶液,然后再滴加足量的FeCl3溶液 | 先产生白色沉淀,然后沉淀变红褐色 | Ksp[Fe(OH)3]>Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第四周期元素中,锰原子价电子层中未成对电子数最多 | |
| B. | 第二周期主族元素的原子半径随核电荷数增大依次减小 | |
| C. | 卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 | |
| D. | 价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
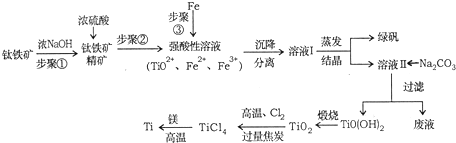
| PH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | TiO(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
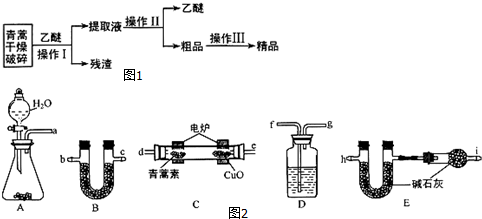
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com