
| A. | 该过程是将化学能转化为热能 | |
| B. | 其发热原理与钢铁的电化学腐蚀相同 | |
| C. | 活性炭作正极,电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 铁作负极,电极反应为:Fe-3e-═Fe3+ |
分析 铁碳和无机盐组成原电池反应,铁做负极,碳做正极;
A、依据分析判断,过程是原电池反应;
B、原电池反应是利用铁和氧气发生的氧化还原反应;
C、正极上是氧气得到电子生成氢氧根离子;
D、铁做负极失电子生成亚铁离子.
解答 解:铁碳和无机盐组成原电池反应,铁做负极,碳做正极,空气中的氧气在正极得到电子发生还原反应;
A、铁碳和无机盐组成原电池反应,铁做负极,碳做正极,过程是原电池反应,发生氧化还原反应将化学能转化为热能,故A正确;
B、原电池反应是利用铁和氧气发生的氧化还原反应,发热原理与钢铁的吸氧腐蚀相同,故B正确;
C、正极上是氧气得到电子生成氢氧根离子电极反应为:2H2O+O2+4e-═4OH-,故C正确;
D、铁做负极失电子生成亚铁离子,电极反应Fe-2e-═Fe2+,故D错误;
故选D.
点评 本题考查了原电池原理的分析应用,掌握原理和电极反应是解题关键,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
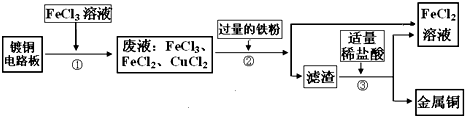
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:CaCl2、NaOH、HCl、HD | B. | 同系物:苯、甲苯、乙苯 | ||
| C. | 有机物:橡胶、硅胶、纤维素、乙醇 | D. | 官能团:氯离子、羟基、硝基、苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原子的电子排布图: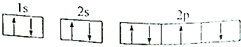 | |
| B. | Mg的基态原子电子排布式为:1s22s22p43s23p1 | |
| C. | ${\;}_{8}^{18}$O2-的结构示意图: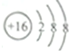 | |
| D. | 过氧化氢的结构式:H-O-O-H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题:
氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题: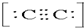 2-.
2-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 丙烯 | C. | 丁烷 | D. | 丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.1% | B. | 2.6% | C. | 0.46% | D. | 0.55% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com