
| A、金刚石>晶体硅>碳化硅 |
| B、CI4>CBr4>CCl4>CH4 |
| C、H2S>H2O>O2 |
| D、金刚石>生铁>纯铁>钠 |


科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入足量烧碱溶液:Ca(HCO3)2+2OH-=CaCO3↓+CO32-+2H2O |
| B、向溴水中通入SO2:Br2+2H2O+SO2=4H++SO42-+2Br- |
| C、向氨水中通过量CO2:2NH3+H2O+CO2=2NH4++CO32-+H2O |
| D、向次氯酸钙溶液中通过少量的SO2:Ca2++2ClO-+SO2=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
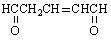 与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A、1mol 2mol |
| B、3mol 4mol |
| C、3mol 2mol |
| D、1mol 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(3) |
| B、(1)(2) |
| C、只有(3) |
| D、只有(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内消耗nmolX同时生成2nmolZ |
| B、混合气体的平均摩尔质量不再变化 |
| C、X、Y、Z的平衡浓度相等 |
| D、V(X)、V(Y)、V(Z)的之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H2SO4>HClO4>HBrO4 |
| B、碱性:NaOH>KOH>RbOH |
| C、非金属性:P>S>Cl |
| D、半径:S2->Cl->Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
| B、金属元素从化合态到游离态,该元素一定被还原 |
| C、非金属元素在化合物中可能呈现正价态 |
| D、金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯水在25℃和100℃时的pH |
| B、相同温度10mL0.1mol?L-1的盐酸溶液与10mL 0.1mol?L-1的醋酸溶液水电离出的c(H+) |
| C、0.1mol/LNaOH溶液分别中和pH、体积均相同的醋酸和盐酸,消耗NaOH溶液的体积 |
| D、相同温度下0.1mol/LCH3COOH溶液和0.3mol/LCH3COOH溶液中的电离平衡常数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com