
已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
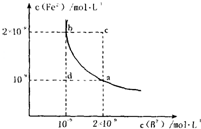
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
(1)无法确定,(2分)NaHB溶液中同时存在HB¯ H++B![]() ,
,
![]() HB¯+H2O H2B+OH¯
HB¯+H2O H2B+OH¯
因两个平衡程度无法确定,故难以确定溶液酸碱性。
(2)α=1%
(3)C、D
(4)C、D
⑴无法确定,因为HB-同时存在HB¯ H++B2-,HB¯+H2O H2B+OH¯两个平衡,因两个平衡程度无法确定,故难以确定溶液酸碱性。
⑵c(B2-)=1×10-6mol·L-1,则由HB-电离出的c(H+)=1×10-6mol·L-1又知pH=3,则溶液中c(H+)=1×10-3mol·L-1,所以H2B第一步电离出的c(H+)=1×10-3-1×10-6 mol·L-1, 则电离度α=![]() 。
。
⑶在NaHB溶液中存在两个守恒,电荷守恒:c(Na+)+c(H+)= c(OH-)+c(HB-)+2c(B2-)
质量守恒:c(Na+)= c(HB-)+c(B2-)+c(H2B)
故C错误;因HB-既存在电离又有消解,所以未全部生成B2-,所以c(Na+)=0.1mol·L-1>c(B2-),故D错误。
⑷在沉淀溶解平衡曲线上的点表示的Ksp相等,故A正确;在d点,还未达到FeB的Ksp,则不会生成沉淀,故B正确;Ksp受温度影响,升温时,Ksp会发生变化,则通过升温不可能由c点变到a点,故C错误;此温度下,KSP=c(Fe2+)·c(B2-)=2×10-9×10-9=2×10-18,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 已知H2B在水溶液中存在以下电离:
已知H2B在水溶液中存在以下电离: H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
查看答案和解析>>
科目:高中化学 来源:2008-2009学年浙江省绍兴一中高三(上)期末化学试卷(解析版) 题型:解答题
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______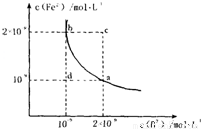
查看答案和解析>>
科目:高中化学 来源:2009年浙江省高考化学模拟最后一卷(解析版) 题型:解答题
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______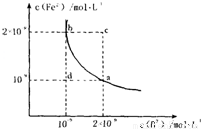
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com