
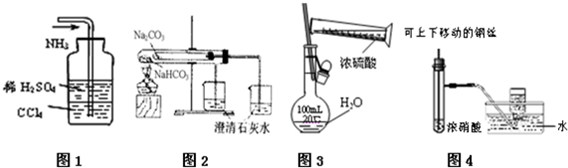
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
分析 A.氨气极易溶于水,不溶于四氯化碳;
B.碳酸钠应该放入直接加热的大试管中;
C.配制溶液时,稀释浓硫酸应该在烧杯中进行;
D.二氧化氮与水反应生成NO和硝酸,无法获得二氧化氮.
解答 解:A.氨气不溶于四氯化碳,该装置能够防倒吸,可用于吸收氨气,故A正确;
B.大试管中温度较高,NaHCO3不稳定,应该将NaHCO3放入小试管,Na2CO3放入大试管,图示装置中药品防止错误,故B错误;
C.稀释浓硫酸应该用硝酸钡,不能在容量瓶中稀释浓硫酸,故C错误;
D.铜与浓硝酸反应生成二氧化氮,二氧化氮与水发生反应,不能用排水法收集,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及气体收集、溶液配制、碳酸钠与碳酸氢钠性质比较等知识,明确常见气体的性质及收集方法为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:多选题
| A. | 着色剂--胡萝卜素、苯甲酸钠 | |
| B. | 调味剂--亚硝酸钠、味精 | |
| C. | 防腐剂--氯化钠、柠檬黄 | |
| D. | 营养强化剂-酱油中加铁、粮食制品中加赖氨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
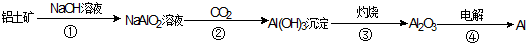
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
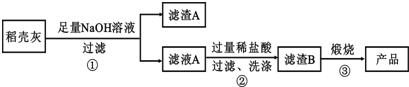
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K |
| 973K | 1.47 |
| 1173K | 2.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
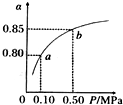 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com