
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

分析 (1)氨气与一氧化氮反应生成氮气和水,依据还原1molNO约放出451.7kJ的热量,结合热化学方程式书写方法写出该反应的热化学方程式;
(2)①根据v=$\frac{△C}{△t}$计算反应速率;
②依据图中数据可知反应进行到20分钟时,反应物、生成物浓度不变,达到平衡状态,根据平衡常数计算平衡常数;
③此反应特点是前后气体分子数不变的反应,增大NO的浓度相当于加压,考虑压强对平衡的影响;
④依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
⑤依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度,据此画出图象;
(3)三价铁离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,已经得失电子守恒写出反应离子方程式;
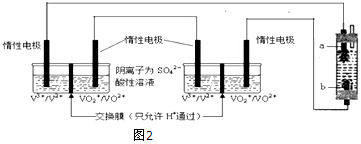
(4)依据电解池中阳极发生氧化反应,阴极发生还原反应,充电时右槽溶液颜色由绿色变为紫色,则V3+得到电子发生氧化反应变为V2+,左槽电极发生还原反应,VO2++得到电子生成VO2+;
放电时,装置为原电池,右槽a电极为正极,发生还原反应,电极反应式为:VO2++2H++e-=VO2++H2O,消耗氢离子;
解答 解:(1)氨气与一氧化氮反应生成氮气和水,还原1molNO约放出451.7kJ的热量,则消耗6molNO放热的热量为27110.2kJ,则该反应的热化学方程式为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1,
故答案为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1;
(2)①10min~20min以v(CO2)=$\frac{△C}{△t}$=$\frac{0.09mol/L}{10min}$=0.009mol•(L•min)-1;
故答案为:0.009mol•(L•min)-1;
②依据图中数据可知20分钟后反应达到平衡状态,平衡时各物质浓度,C(NO)=0.40mol•(L•min)-1; C(N2)=0.30mol•(L•min)-1; C(CO2)=0.30mol•(L•min)-1;
平衡常数K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.3×0.3}{0.4×0.4}$=0.56;
故答案为:K=0.56;
③此反应特点是前后气体分子数不变的反应,增大NO的浓度相当于加压,加压对平衡无影响,故NO的转化率不变,
故答案为:不变;
④C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应,
a.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故a错误;
b.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,故b错误;
c.容器内CO2的体积分数不变,说明反应达到平衡,故c正确;
d.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故d正确;
故选:cd;
⑤30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.34×0.17}{0.32×0.32}$=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果;依据二氧化碳浓度减小在图象中画出浓度变化如图所示,作图要点:①起点在30min时V逆(CO2)的一半左右;②终点不超过30min时V逆(CO2),则图象为 ,
,
故答案为:减小CO2 的浓度; ;
;
(3)30min时改变某一条件,反应重新达到平衡时c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;则平衡常数K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.34×0.17}{0.32×0.32}$=0.56,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果,
故答案为:减小二氧化碳浓度;
(4)充电时右槽溶液颜色由绿色变为紫色,则V3+得到电子发生还原反应变为V2+,电解池中发生氧化反应的一极为阳极,与电源的正极相连,发生还原反应的极为阴极,与电源负极相连,所以b极接直流电源的负极;
a极为阳极,发生氧化反应电极反应式为:VO2++H2O-e-═VO2++2H+;
放电时,装置为原电池,右槽a电极为正极,发生还原反应,电极反应式为:VO2++2H++e-=VO2++H2O,消耗氢离子,溶液的pH值变大;
故答案为:负极;VO2++2H++e-=VO2++H2O;增大.
点评 本题为综合题,考查了热化学方程式的书写、反应速率、平衡常数的计算、化学平衡状态的判断、原电池、电解池工作原理,题目难度较大,熟悉相关知识是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,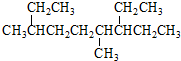 的名称为3,6-二甲基-7-乙基壬烷 的名称为3,6-二甲基-7-乙基壬烷 | |
| B. | 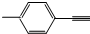 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 标准状况下,1 L辛烷完全燃烧生成CO28L | |
| D. | 1.0 mol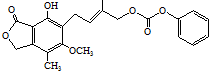 最多能与5.0 mol NaOH水溶液完全反应 最多能与5.0 mol NaOH水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
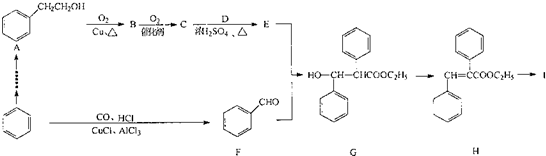
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
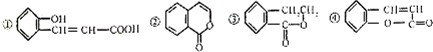
| A. | 只有①能和碳酸钠反应放出气体 | B. | ②和④互为同分异构体 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④与H2加成后可以得到③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白色沉淀甲是Al(OH)3,气体甲是CO2,原混合物中一定含有Al3+和HCO3- | |
| B. | 白色沉淀乙是BaSO4,原混合物中一定含有SO42- | |
| C. | 气体乙一定是NO和NO2的混合气体 | |
| D. | 原混合物中一定含有Na+、Al3+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的电离程度:RYX>R2W | |
| C. | 热稳定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com