

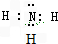 ,J为NH4NO3,为离子晶体,故答案为:
,J为NH4NO3,为离子晶体,故答案为: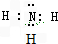 ; 离子晶体;
; 离子晶体;
| ||
| 高温高压 |
| ||
| 高温高压 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸滴入氨水中:H++OH-=H2O |
| B、Na2S的水解反应:S2-+2H2O=H2S↑+2OH- |
| C、在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO3-+Ca2++2OH一=MgCO3↓+CaCO3↓+2H2O |
| D、铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:C2H4 | ||
B、中子数为20的钾原子:
| ||
C、次氯酸的电子式: | ||
D、CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )
如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )| A、溶液的pH | ||
| B、Ka(HA) | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 2 |
| A、乙炔的燃烧热为1256 kJ/mol |
| B、若转移10 mol电子,则消耗2.5 mol O2 |
| C、该反应在给定条件下是一个熵增焓减的反应 |
| D、若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )| A、Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mol?L-l |
| B、Fe3+不能提高乙酸降解速率 |
| C、相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
| D、该实验方案的缺陷之一是未做空白对照实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com