
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
分析 A.浓硫酸的脱水性是分子中氢和氧按2:1易水的形式脱去;
B.根据难挥发性酸制备易挥发性酸的规律解答;
C.依据浓硫酸的强的氧化性解答;
D.依据浓硫酸在反应中硫元素化合价变化判断.
解答 解:A.浓硫酸可将许多有机化合物反应时,按水分子中氢、氧原子数的比(2:1)夺取这些有机物分子里的氢原子和氧原子,在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性,故A正确;
B.浓硫酸难挥发,浓盐酸易挥发,浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸,故B正确;
C.浓硫酸具有强的氧化性,常温下能够使铝发生钝化,阻止反应进行,钝化属于化学反应,故C错误;
D.在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4中硫元素化合价部分降低,部分不变,表现浓硫酸氧化性和酸性,故D错误;
故选:CD.
点评 本题考查浓硫酸的性质,题目难度不大,熟悉浓硫酸的吸水性、脱水性以及强氧化性等性质是解题关键,注意钝化属于化学反应,题目难度不大.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
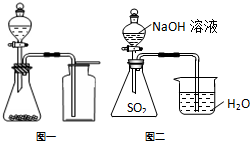
| A. | 氯气通入澄清石灰水中,制取漂白粉 | |
| B. | 可通过化合反应得到Fe(OH)3 | |
| C. | 选择合适的试剂,用图一所示装置可分别制取少量CO2、NO和O2 | |
| D. | 用图二的装置可证明SO2与NaOH发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①达到平衡时,增大压强平衡不移动 | |
| B. | 反应②的平衡常数表达式为K=$\frac{c(C{O}_{2})•c(S{O}_{2})}{C(CO)}$ | |
| C. | 反应①和②是主反应,反应③是副反应 | |
| D. | 2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Ca2+的浓度减小 | B. | 溶液质量增大 | ||
| C. | 溶液中Ca(OH)2的质量分数不变 | D. | 溶液中OH-的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液后过滤 | |
| C. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| D. | Na2O2粉末(Na2O),将混合物在空气中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 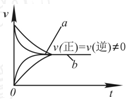 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 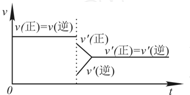 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
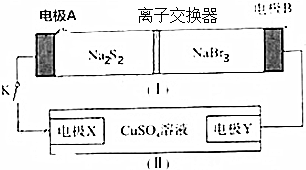
| A. | 装置①中钠离子从右到左通过离子交换膜 | |
| B. | B极的电极反应式为NaBr3+2e-+2Na═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1mol Na+通过离子交换膜,X电极上析出固体物质0.64g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com