
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用Al2O3+3C+N2![]() 2AlN+3CO制取氮化铝,设计如图实验装置:
2AlN+3CO制取氮化铝,设计如图实验装置:

试回答:
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为___。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是__(填写序号)。
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,___。

(4)化学研究小组的装置存在严重问题,请说明改进的办法:___。
(5)反应结束后,某同学用如图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气。
①广口瓶中的试剂X最好选用___(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将___(填“偏大”、“偏小”或“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为___。
【答案】NaNO2+NH4Cl![]() NaCl+N2↑+2H2O c 用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好 在干燥管D末端连接一个尾气处理装置 c 不变 61.5%
NaCl+N2↑+2H2O c 用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好 在干燥管D末端连接一个尾气处理装置 c 不变 61.5%
【解析】
制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2
NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2![]() 2AlN+3CO,D防止空气进入反应装置干扰实验;
2AlN+3CO,D防止空气进入反应装置干扰实验;
(1)饱和NaNO2与 NH4Cl溶液应生成氯化钠、氮气和水;
(2)根据实验的需要结合大气压强原理来回答;
(3)只要先将装置密封再利用热胀冷缩原理进行气密性验证;
(4)实验必须对有毒气体进行尾气处理,防止空气污染;
(5)氮化铝和氢氧化钠反应会生成氨气,氨气进入广口瓶后,如果装置密闭,广口瓶中压强会增大,那么就会有水通过广口瓶的长管进入量筒中,根据等量法可知,进入到广口瓶中水的体积就等于生成的氨气的体积.所以通过量筒中排出的水的体积就可以知道氨气的体积,然后有氨气的密度求出氨气的质量,进而根据方程式求出氮化铝的质量。
①产生的氨气极易溶于水,为防止氨气溶于水需要把气体与水隔离,因此应选择不能与氨气产生作用的液体作为隔离液;选用的试剂应是和水不互溶,且密度大于水的;
②反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中充入的氨气当成开始时的空气即可;
③根据氨气的体积计算出物质的量,得出其中氮原子的物质的量,根据氮原子守恒,来计算氮化铝的百分含量。
制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2
NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2![]() 2AlN+3CO,D防止空气进入反应装置干扰实验。
2AlN+3CO,D防止空气进入反应装置干扰实验。
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;故答案为:NaNO2+NH4Cl
NaCl+N2↑+2H2O;故答案为:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,故选c;
(3)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,故答案为:用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好;
(4)实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,故答案为:在干燥管D末端连接一个尾气处理装置;
(5)①酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;故答案为:c;
②本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,故答案为:不变;
③氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为![]() ×100%=61.5%,故答案为:61.5%。
×100%=61.5%,故答案为:61.5%。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】已知反应![]() 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是
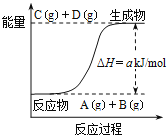
A.该体系的压强不变时标志此反应处于平衡状态
B.若该反应中有电子得失,则可设计成原电池
C.反应物的总键能高于生成物的总键能
D.该反应中的反应物A和B的转化率一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20 mL N mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示。下列说法中,正确的是

A.a点c(CH3COOH)=10-3mol·L-1
B.b点溶液中离子浓度大小满足关系: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点溶液中离子浓度大小满足关系: c(Na+)+c(OH-)=c(H+)+c(CH3COO-)
D.滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10毫升某气态烃在80毫升氧气中完全燃烧后,恢复到原来状况(1.01×105Pa , 270C)时,测得气体体积为70毫升,求此烃的分子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见图。

①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.①③⑤B.②③④C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分之一,其相对分子质量为28,现以A为原料合成乙酸乙酯。请回答下列问题。
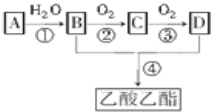
(1)结构简式:A____;C ___。
(2)写出化合物官能团名称:B____。
(3)写出反应的化学方程式④:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com