

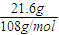 ═0.2mol,转移电子0.2mol,根据2H2O+2e-═H2↑+2OH-,可以判断出生成n(OH-)═0.2mol,则c(OH-)═
═0.2mol,转移电子0.2mol,根据2H2O+2e-═H2↑+2OH-,可以判断出生成n(OH-)═0.2mol,则c(OH-)═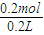 ═1mol/L,
═1mol/L,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
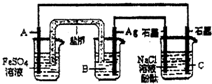
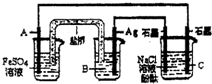 利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计.下列有关叙述错误的是( )
利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计.下列有关叙述错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的 极,材料是 ,该极上出现的现象是 ,写出该电极的反应式 。
(2)a可能为
A、铜 B、银 C、铁 D、石墨
(3)c溶液是
A、CuSO4溶液 B、AgNO3溶液 C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为 克。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红 |
| B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2↑ |
| C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-=Fe2+ |
| D.当析出Ag21.6g时,NaCl溶液的pH是反应前的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com